
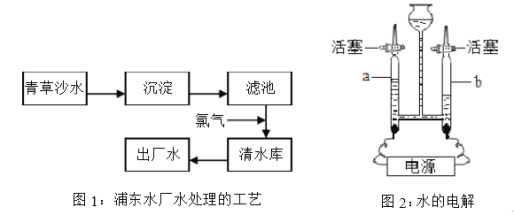
【题目】人类的生产和生活都离不开水,2013年8月起,浦东居民全部喝上了青草沙优质水。
①在图1中,氯气的作用是 ,出厂水是 (填“纯净物”或“混合物”)。
②图2的实验中,反应的化学方程式为 ,检验a管中气体的方法是 。
③青草沙水含氯化钠、氯化钾和硫酸锂等矿物质。
根据下图回答问题:
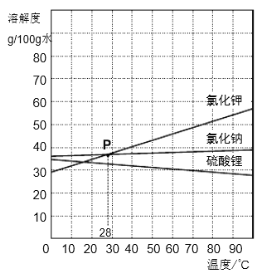
Ⅰ.随温度升高,硫酸锂溶解度的变化趋势是 。
Ⅱ.40℃时,12g氯化钾固体溶于25g水中,成分搅拌,所得溶液的溶质质量分数为 。
Ⅲ.上图中P点的含义是 。
Ⅳ.分别将100g氯化钠、硫酸锂的饱和溶液从80℃降温至10℃,对所得溶液的叙述正确的是 。
A.两者均为饱和溶液
B.溶液质量:氯化钠<硫酸锂
C.溶剂质量:两者相等
D.溶质质量分数:氯化钠>硫酸锂
【答案】①杀菌消毒;混合物;②![]() ;把带火星的木条放在a的管口,观察现象;
;把带火星的木条放在a的管口,观察现象;
③Ⅰ. 随温度的升高而逐渐减小;Ⅱ. 28.6%;Ⅲ. 28℃时氯化钾与氯化钠的溶解度相等;Ⅳ.BD
【解析】①在图1中,氯气的作用是杀菌消毒,出厂水依然含有一些可溶性物质,属于混合物;
②图2是水电解的实验,反应的化学方程式为:![]() ,由图示可知a中气体较少,为氧气,检验氧气的方法是打开活塞,把带火星的木条放在a的排气管口,观察现象;③Ⅰ.随温度升高,硫酸锂溶解度随温度的升高而逐渐减小;Ⅱ.40℃时,氯化钾的溶解度为40g,所以12g氯化钾固体溶于25g水中达到饱和状态且有2g溶质剩余,因此所得溶液的溶质质量分数为
,由图示可知a中气体较少,为氧气,检验氧气的方法是打开活塞,把带火星的木条放在a的排气管口,观察现象;③Ⅰ.随温度升高,硫酸锂溶解度随温度的升高而逐渐减小;Ⅱ.40℃时,氯化钾的溶解度为40g,所以12g氯化钾固体溶于25g水中达到饱和状态且有2g溶质剩余,因此所得溶液的溶质质量分数为![]() 100%=28.6%Ⅲ.右图中P点的含义表示28℃时氯化钾与氯化钠的溶解度相等;Ⅳ.分别将100g氯化钠、硫酸锂的饱和溶液从80℃降温至10℃,因为氯化钠的溶解度随温度的降低而减小,所以溶液中有溶质析出,仍为饱和状态,溶质、溶液质量减少,溶质质量分数减小,硫酸锂的溶解度随温度的降低而增大,所以溶液由饱和状态变为不饱和状态,溶液中的其他量没有发生变化;又因为80℃、10℃时氯化钠的溶解度的大于硫酸锂的溶解度,所以氯化钠饱和溶液中溶剂质量小于硫酸锂溶液中所含的溶剂质量,溶质质量分数也是氯化钠大于硫酸锂,故叙述正确的是BD.
100%=28.6%Ⅲ.右图中P点的含义表示28℃时氯化钾与氯化钠的溶解度相等;Ⅳ.分别将100g氯化钠、硫酸锂的饱和溶液从80℃降温至10℃,因为氯化钠的溶解度随温度的降低而减小,所以溶液中有溶质析出,仍为饱和状态,溶质、溶液质量减少,溶质质量分数减小,硫酸锂的溶解度随温度的降低而增大,所以溶液由饱和状态变为不饱和状态,溶液中的其他量没有发生变化;又因为80℃、10℃时氯化钠的溶解度的大于硫酸锂的溶解度,所以氯化钠饱和溶液中溶剂质量小于硫酸锂溶液中所含的溶剂质量,溶质质量分数也是氯化钠大于硫酸锂,故叙述正确的是BD.
试题分析:①根据氯气的性质和用途分析,根据纯净物含一种物质,混合物含有多种物质分析;②根据电解水实验的现象可以描述为:“正氧负氢,氢二氧一”分析;根据氧气具有助燃性,检验用带火星的木条分析;③根据溶解度曲线表示的意义分析;根据饱和溶液中溶质质量分数=![]() 计算溶液的溶质质量分数;根据不同温度下,物质的溶解度分析改变温度后,溶液中溶质、溶剂、溶质质量分数及状态的变化情况.
计算溶液的溶质质量分数;根据不同温度下,物质的溶解度分析改变温度后,溶液中溶质、溶剂、溶质质量分数及状态的变化情况.
考点:水的净化方法;纯净物与混合物的区别;电解水的实验现象及气体的检验方法;溶解度曲线表示的意义及其应用;饱和溶液与不饱和溶液的特点;物质的结晶方法


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组为了测定某一碳酸钠样品中碳酸钠的质量分数,进行如下实验,取13.25g碳酸钠样品(杂质既不溶于酸也不溶于水)放入烧杯中,加入95.8g水使其完全溶解,再向其中加入稀盐酸,测得反应放出气体的总质量与所加入稀盐酸的质量关系曲线如图所示,请回答:
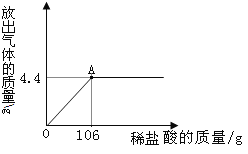
(1)当加入212g稀盐酸时,放出气体的质量为__________g
(2)碳酸钠样品中碳酸钠的质量分数为多少?(写出计算过程)
(3)加入106g稀盐酸(即A点)时烧杯中溶液溶质的质量分数为多少?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验现象描述正确的是
A.白磷燃烧产生大量的白雾 B.点燃纯净氢气产生蓝紫色火焰
C.铁丝在空气中燃烧火星四射 D.镁条在空气中燃烧发出耀眼白光
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明同学用盐酸和碳酸钙反应制取二氧化碳,考虑到盐酸的挥发性等原因,制得的二氧化碳中含有少量的氯化氢和水蒸气,为了收集收集一瓶干燥、纯净的二氧化碳气体,小明同学设计了如下图所示的实验装置。
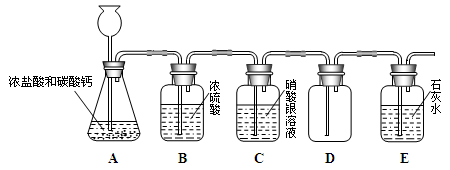
试回答下列问题:
(1)写出A中发生反应的化学方程式: 。
(2)看到 现象时,说明D装置内的二氧化碳已经收集满了。
(3)B装置的作用是 。
(4)C装置的作用是 。
(5)对于小明同学设计的这个实验方案,谈谈你的改进建议 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】通过比较相同时间内产生氧气的体积可探究影响过氧化氢分解速率的因素。
(1)用以下装置进行实验并绘制曲线如图。
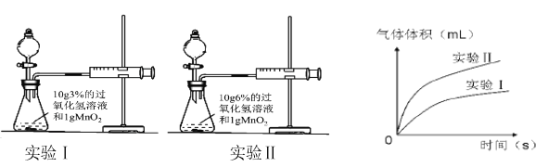
根据上图信息可知,该因素对过氧化氢分解速率的影响是 。
(2)探究温度及催化剂质量的影响。请补填实验V中的数据。
实验编号 | 温度 | 催化剂 | 过氧化氢溶液的质量及浓度 |
实验Ⅲ | 50℃ | 1g二氧化锰 | 10g,3% |
实验Ⅳ | 25℃ | 2g二氧化锰 | 10g,3% |
实验Ⅴ | 10g,3% |
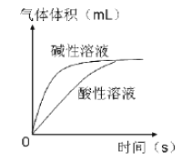
(3)溶液酸碱性对过氧化氢的分解速率也有影响。
①分析下图,可得出的结论是 。
②资料表明:过氧化钡(![]() )与硫酸(
)与硫酸(![]() )溶液反应可用来制取
)溶液反应可用来制取![]() ,同时生成一种白色沉淀硫酸钡(
,同时生成一种白色沉淀硫酸钡(![]() ),该反应的化学方程式为 ;从反应后的混合物中除去硫酸钡沉淀的实验操作是 ;根据①中结论可知,利用上述反应制取
),该反应的化学方程式为 ;从反应后的混合物中除去硫酸钡沉淀的实验操作是 ;根据①中结论可知,利用上述反应制取![]() 时,所加硫酸的量应 (填“少量”或“过量”)。
时,所加硫酸的量应 (填“少量”或“过量”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种新型高效的水处理剂。下列有关高铁酸钾的说法正确是
A.属于氧化物
B.钾、铁、氧三种元素质量比是2:1:4
C.铁元素化合价为+6
D.由两种非金属元素和一种金属元素组成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二氧化硫是造成酸雨的主要物质之一。小丽为探究二氧化硫能与水反应生成酸,设计了如下实验方案。
【实验设计】她先用紫色石蕊溶液将白色滤纸浸润,干燥后做成紫色的小花,然后按下列图示进行实验。观察到实验(I)和(III)中的小花变红,(II)中的小花不变色。

【评价反思】小虎对小丽的实验方案提出了质疑,他认为上述实验不足以证明“二氧化硫和水反应生成了酸”。两位同学仔细讨论后认为还需补充如下一个实验,才能得出二氧化硫与水反应生成酸。
实验操作 | 实验现象 |
__________________ | __________________ |
【拓展应用】二氧化硫也是实验室一种污染气体,常用碱液吸收。写出实验室用氢氧化钠溶液吸收二氧化硫的化学方程式:_____________________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com