
(8分)某校化学兴趣小组就空气中氧气的含量进行实验探究:
【集体设计】
化学兴趣小组的同学经过研究讨论后,采用燃烧方法除去氧气后,测定剩余气体的体积。但首先需要解决两个实际问题:
(1)要能确保消耗其中的氧气,使气体的体积减小,选择什么样的药品就显得很重要。他们应该选择下列物质中的(填编号)______________ 。
A.蜡烛 B.红磷 C.硫粉 D.木炭
(2)药品的取用量也有相应要求。你认为取用量应达到什么要求?______ _______。
【设计实验】
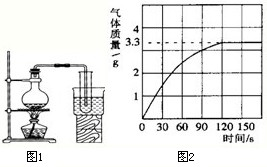
第一小组同学共同设计了如下图的A、B两套装置。
(3)你认为合理的是(填编号)____________。
(4)为了确保实验的成功,在装药品之前应该先检查____________________。
(5)集气瓶中所选择物质燃烧反应的反应表达式是_______________________。
【改进实验】
第二小组同学查阅资料得知:白磷不溶于水,露置在空气中容易发生缓慢氧化而引起自燃,而燃烧产生的五氧化二磷会刺激人的呼吸道。于是他们将试管的容积分成五等份,做好标记(如图C)。在试管中加入一小块(足量)白磷,迅速用橡皮塞塞紧试管口,将试管放入热水中,使白磷燃烧。待白磷熄灭并冷却到室温后,再将试管倒立于盛有水的水槽中,并在水中将橡皮塞取下。
(6)此装置的优点是(任写两点)
①________________________________;②______________________________。
(7)小组A同学用镊子从容器中取出白磷后,准备在滤纸上切割时,B同学立刻阻止了他,指出他的操作不正确,请分析原因_____________________________________。
(1)B (2)红磷过量
(3)A (4)装置气密性
(5)P+O2 P2O5
P2O5
(6)防止产生的五氧化二磷被吸入至呼吸道;测定结果更加精确
(7)防止白磷在空气中切割时引起自燃,造成实验危险。
解析试题分析:用燃烧法测定空气中氧气的体积分数,关键要做到以下几点:1、装置气密性良好;2、可燃物在空气中容易燃烧,且燃烧后不会生成其他气体,一般选用红磷;3、可燃物(红磷)的量要充足。
(1) 要能确保消耗其中的氧气,使气体的体积减小,应选择红磷,因为红磷燃烧后生成五氧化二磷固体,而蜡烛、硫、木炭燃烧后都会有气体生成,瓶内气体体积改变受影响;
(2) 红磷的量要保证过量,以确保瓶内氧气被全部消耗完;
(3) 题中A装置合理;燃烧匙伸至瓶底,可以将氧气耗尽;
(4)为了确保实验的成功,在装药品之前应该先检查装置气密性;
(5)集气瓶中所选择物质燃烧反应的反应表达式是P+O2 P2O5
P2O5
(6)题中C装置在水下进行,优点有:防止产生的五氧化二磷被吸入至呼吸道;测定结果更加精确;
(7)白磷在空气中容易因缓慢氧化而自燃,为防止白磷在空气中切割时引起自燃,造成实验危险,故不能在空气中切割白磷。
考点:空气中氧气体积分数的测定。
点评:用燃烧法测定空气中氧气的体积分数,成功的关键是要做到以下几点:1、装置气密性良好;2、可燃物在空气中容易燃烧,且燃烧后不会生成其他气体,一般选用红磷;3、可燃物(红磷)的量要充足。


科目:初中化学 来源: 题型:阅读理解
 水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.
水是重要的资源,是人及一切生物生存所必需的,自然界的水含有各种杂质,很少能直接使用,须进行净化.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源:2010年广西梧州市中考化学试卷(样卷)(解析版) 题型:填空题

查看答案和解析>>
科目:初中化学 来源:2012年江苏省镇江市索普实验学校中考化学模拟试卷(8)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com