
分析 二氧化碳能和水反应生成碳酸,碳酸显酸性,能使石蕊试液变红色.碳酸不稳定,受热容易分解生成水和二氧化碳.根据反应物和生成物及其质量守恒定律可以正确的书写化学方程式.
解答 解:二氧化碳和水反应生成的碳酸能使石蕊试液变红色;二氧化碳和水反应生成碳酸,反应的化学方程式为:CO2+H2O=H2CO3,该反应属于化合反应;碳酸受热能生成水和二氧化碳,水不能使石蕊试液变色.碳酸受热分解生成水和二氧化碳的化学方程式为:H2CO3=CO2↑+H2O.
故答案为:红;CO2+H2O=H2CO3,化合,紫;H2CO3=CO2↑+H2O.
点评 此题主要是对二氧化碳性质的考查,解题的关键是对二氧化碳与水的反应及碳酸受热分解的理解及掌握,属基础性知识考查题.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
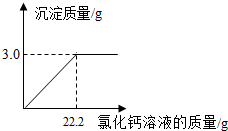 用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠,为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g.充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示,求该纯碱样品中碳酸钠的质量分数.(精确到0.1%)
用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠,为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g.充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示,求该纯碱样品中碳酸钠的质量分数.(精确到0.1%)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 化学就在我们身边,它与我们的生活息息相关.
化学就在我们身边,它与我们的生活息息相关.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | ZnCl2溶液 | CuCl2 | 过量锌粉,过滤 |
| B | CaCl2溶液 | 盐酸 | 加适量 NaOH |
| C | CuO | Cu | 加水,过滤 |
| D | O2 | H2 | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 实验探究研究性学习小组选择“H2O2生成氧气的快慢与什么因素有关”的课题进行【假设】H2O2生成O2的快慢与催化剂的种类有关.
实验探究研究性学习小组选择“H2O2生成氧气的快慢与什么因素有关”的课题进行【假设】H2O2生成O2的快慢与催化剂的种类有关.| 实验编号 | 1 | 2 |
| 反应物 | 6% H2O2 | 6% H2O2 |
| 催化剂 | 1g红砖粉 | 1g MnO2 |
| 时间 | 152秒 | 35秒 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K+、NO3-、SO42-、Cu2+ | B. | Ag+、K+、Cl-、NO3- | ||
| C. | K+、NO3-、Na+、OH- | D. | H+、Ba2+、Cl-、SO42- |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com