
| 温度/℃ | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | 18.9 | 37.2 | 50.0 | 48.3 | 45.8 |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:初中化学 来源: 题型:
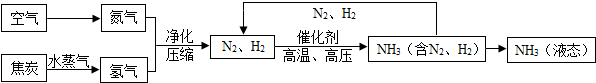
| ||
| 物质 | H2 | N2 | O2 | NH3 |
| 沸点 | -252℃ | -195.8℃ | -183℃ | -33.35℃ |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
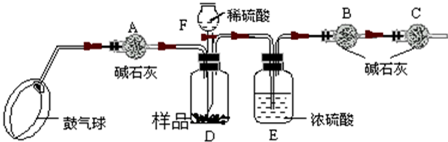
查看答案和解析>>
科目:初中化学 来源: 题型:
 |
0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 氯化铵 | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 | 60.2 | 65.6 |
| 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 |

查看答案和解析>>
科目:初中化学 来源: 题型:
| 金属种类 | 锰(Mn) | 镁 | 铜 |
| 与盐酸反应 | 略慢 | 快 | 无明显现象 |
| 等质量的金属(a克)与足量盐酸反应 | 镁 | 铁 | 锰 | ||||||
| 金属的相对原子质量 | 24 | 56 | 55 | ||||||
| 产生氢气的质量(g) |
|
|
| ||||||
| 找到的规律 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、反应的NaOH和CuSO4的质量总和等于生成蓝色沉淀的质量 |
| B、10g食盐放入90g水中完全溶解形成100g食盐水,遵守质量守恒定律 |
| C、酒精燃烧连灰烬都没有留下,这不符合质量守恒定律 |
| D、1g氢气在8g氧气中燃烧可生成9g水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com