
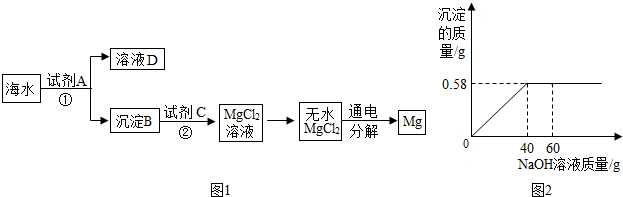
分析 (1)根据过滤操作的名称分析即可;
(2)根据元素守恒分析;
(3)从海水屮提取MgCl2时.经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程是将海水中的镁离子提取出来,富集镁离子;
(4)根据氢氧化镁沉淀的质量可以计算海水样品中所含氯化镁的质量分数.
解答 解:(1)根据题意,经过①操作混合物就分离为溶液和沉淀,所以操作①为过滤操作;
故答案为:过滤;
(2)因为Mg(OH)2与试剂C反应生成MgCl2.6H2O,根据元素守恒可知C是盐酸;
故答案为:HCl;
(3)海水中含有氯化镁,氯化镁溶解在海水中,不能直接提取出来,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程富集MgCl2,得到纯净的氯化镁,然后电解才能得到镁.
故答案为:富集MgCl2,得到纯净的MgCl2;
(4)解:设上述190g海水样品中所含氯化镁的质量为x,
MgCl2+2NaOH═Mg(OH)2↓+2NaCl,
95 58
x 0.58g
$\frac{95}{58}=\frac{x}{0.58g}$
x=0.95g,
上述海水样品中氯化镁的溶质质量分数是:$\frac{0.95g}{190g}×100%$=0.55%.
答:上述190g海水样品中所含氯化镁的质量分数为0.55%.
故答案为:0.55%.
点评 本题主要考查计算和推断的能力,计算时要注意规范性和准确性.


科目:初中化学 来源: 题型:多选题
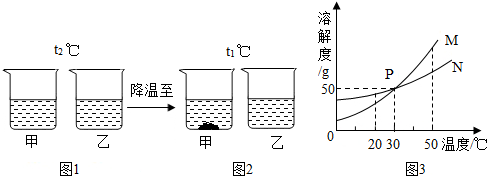
| A. | 图3中M表示的是乙的溶解度曲线 | |
| B. | 图2中甲溶液一定饱和,乙溶液不一定饱和 | |
| C. | 图2乙溶液一定比甲溶液浓 | |
| D. | 当W=50g时,甲、乙溶液溶质质量分数一定相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用霉变的花生榨取食用油 | |
| B. | 室内有煤气泄露,立即打开排气扇通风 | |
| C. | 铵态氮肥可与碱性物质混用 | |
| D. | 久未开启的地窖、窖井,不可冒然进入 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 步骤Ⅰ可除去难溶性杂质 | B. | X可以是活性炭 | ||
| C. | 步骤Ⅲ可杀菌、消毒 | D. | 净化后的水是纯净物 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 物质在水中的溶解过程实质上是原子重新组合的过程 | |
| B. | 水的三态变化中,分子的能量、运动速率不变 | |
| C. | 分子可以再分,原子不能再分 | |
| D. | 分子由原子构成 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
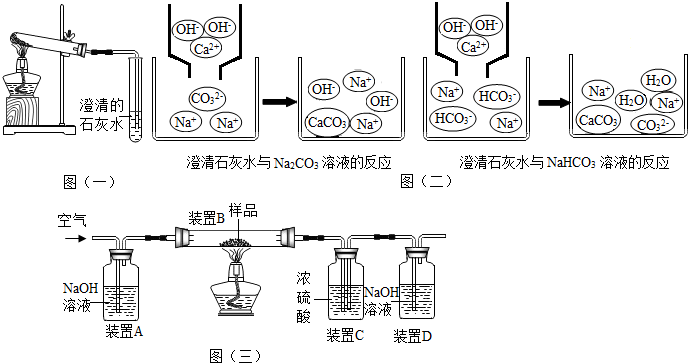
| 装置B | 装置C | 装置D | |
| 实验前物质的质量/g | 180.0 | 200.0 | 122.2 |
| 实验后物质的质量/g | 176.9 | 201.5 | 124.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com