
【题目】向一定量Ba(OH)2的溶液中加入稀H2SO4溶液,与反应有关的变化关系用下图表示,其中错误的是

A. A B. B C. C D. D
【答案】B
【解析】A、Ba(OH)2的溶液呈碱性,开始溶液的pH大于7,随反应的进行氢氧化钡逐渐减少,pH变小,刚好完全反应时pH=7;酸过量时,pH小于7.图像正确;B、氢氧化钡最终能被反应完,最后氢氧化钡的质量为零,B错误;C、Ba(OH)2的溶液中加入稀H2SO4溶液,随反应的进行,生成物硫酸钡逐渐增多,氢氧化钡被反应完,硫酸钡的质量达到最大值,并不再改变,C正确;溶液中的导电微粒是溶液中自由的离子,反应中离子逐渐减少,所以导电性逐渐变小,刚好完全反应时只有沉淀和水,没有离子,导电性为零,酸过量后,溶液中的又有了氢离子和硫酸根离子,并不断增多,所以导电性又逐渐增强。D正确;选B


科目:初中化学 来源: 题型:
【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定了反应后溶液的pH,得到了如下图所示的pH曲线,请回答:
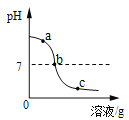
(1)由图可知该实验操作是将__________滴加到另一种溶液中;
(2)该反应的化学方程式为___________;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl。
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现___________的现象。结论:该样品是a处溶液。
②为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液。 | ________ | 该样品为b处溶液。 |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】Ⅰ.质量守恒定律的发现对化学的发展做出了重要贡献。
(1)通过称量下列各组试剂在密闭容器内混合前后的总质量,能验证质量守恒定律的
是____________(填数字序号)。
① 食盐和水 ② 氯化钠溶液和硝酸钾溶液 ③ 铁和氯化铜溶液
(2)某反应的微观示意图如下图所示:
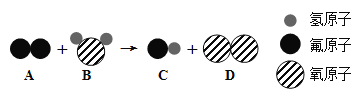
① A的化学式为_________。
② 该反应所属的基本反应类型为___________________反应。
③ 参加反应的A物质和生成的C物质分子数目比为____________________。
Ⅱ.甲和乙两种固态物质的饱和溶液中溶质质量分数与温度的关系如右图所示:
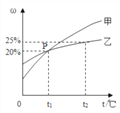
(1)甲和乙两种物质的溶解度随温度的升高而___________(填“增大”或“减小”)。
(2)下列对P点的含义叙述正确的是_____________(填字母序号)。
A.t1℃时,甲和乙两种物质的溶解度相等
B.t1℃时,甲和乙两种物质溶液的溶质质量分数相等
C.t1℃时,甲和乙两种物质的饱和溶液中溶质的质量相等
(3)25 g乙物质完全溶于100g水中所需的最低温度是________℃。
(4)t2℃时,若甲和乙两种物质的饱和溶液中析出等量的固体须蒸发掉较多水的是_________(填“甲”或“乙”)物质饱和溶液。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组用如图所示装置制取氧气,试管中固体的质量随时间变化的数据见下表。制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾不饱和溶液100g。

加热时间/min | 0 | t1 | t2 | t3 |
固体质量/g | 28.0 | 23.2 | 18.4 | 18.4 |
(1)共制得氧气 g。
(2)计算所得氯化钾溶液的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有30℃时的氯化钠饱和溶液,在下列情况下溶液中溶质的质量分数不变的是
A. 温度不变,向溶液中加入氯化钠晶体 B. 温度不变,向溶液中加入水
C. 升高温度蒸发掉一部分水,温度保持在40℃ D. 降温至10℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com