
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量剩余固体于试管中,加水振荡,过滤 取滤液滴加无色酚酞溶液 取滤渣滴加足量的稀盐酸 | 溶液变红 有气泡产生 | 猜想Ⅱ成立 |
分析 根据物质的性质进行分析,碳酸钙高温能分解生成氧化钙和二氧化碳,氧化钙能与水反应生成氢氧化钙,氢氧化钙是微溶于水的物质,其水溶液呈碱性,碳酸钙能与盐酸反应生成二氧化碳气体.
解答 解:
工业上通常采用高温煅烧石灰石的方法制生石灰,化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
【猜想与假设】Ⅱ.部分反应的情况既有氧化钙也有碳酸钙;
①取一定量的剩余固体于试管中,加入一定量的水振荡,有白色不溶物不足以说明只有碳酸钙,因为氧化钙与水反应生成的氢氧化钙微溶于水,也是白色沉淀;
②取一定量的剩余固体于试管中,加入一定量的水,触摸试管外壁感觉发热,继续向试管中加入几滴稀盐酸,没有气泡产生,说明有氧化钙,氧化钙与水反应生成氢氧化钙,不能说明猜想Ⅲ成立,原因是即使有碳酸钙,加入的少量稀盐酸先消耗氢氧化钙,也不会出现气泡;
③利用水、无色酚酞溶液证明氧化钙与水反应生成氢氧化钙,用稀盐酸证明碳酸钙存在;步骤如下:
| 实验步骤 | 实验现象 |
| 取少量剩余固体于试管中,加水振荡,过滤 取滤液滴加无色酚酞溶液 取滤渣滴加足量的稀盐酸 | 溶液变红 有气泡产生 |
| 实验步骤 | 实验现象 |
| 取少量剩余固体于试管中,加水振荡,过滤 取滤液滴加无色酚酞溶液 取滤渣滴加足量的稀盐酸 | 溶液变红 有气泡产生 |
点评 本题考查了物质变质成分的探究,完成此题,可以依据已有的物质的性质进行.要求同学们熟练掌握常见物质的性质,以便灵活应用.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
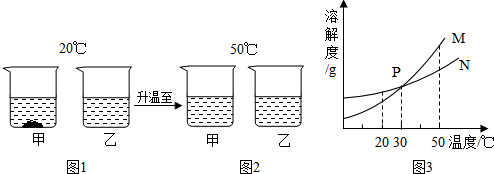
| A. | 图1中乙一定是饱和溶液 | |
| B. | 图2中两溶液中溶质的质量分数一定相等 | |
| C. | 图3中N表示甲的溶解度曲线 | |
| D. | 图2中两溶液降温至30℃一定会析出晶体 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 过碳酸钠的水溶液能使无色酚酞变红,所以过碳酸钠是一种碱 | |
| B. | 过碳酸钠(Na2CO4)漂白杀菌时,发生了化学变化 | |
| C. | 过碳酸钠(Na2CO4)中碳元素的化合价为+4价 | |
| D. | 测定与盐酸反应后气体的总体积,可推算出过碳酸钠的纯度 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com