
【题目】金属材料是日常生活中应用广泛的材料,请回答下列与金属有关的问题。

(1)汽车的外部材料如图1所示,含有的金属元素是____________(填元素符号,填一种)。含有的有机合成材料是________________(填材料名称,填一种)。
(2)车身喷漆处理既美观又防锈,喷漆防锈的原理是____________________________________。
(3)铝的抗腐蚀性能好,原因是__________________________(用化学方程式表示)。
(4)等质量的甲、乙、丙三种金属的粉末,与足量的稀硫酸反应(反应后甲、乙、丙三种金属均显+2价),生成H2的质量与反应时间的关系如图2所示,下列说法不正确的是_____________。
A 三种金属的活泼性:乙>甲>丙
B 生成氢气的质量:甲>乙>丙
C 相对原子质量:甲>乙>丙
D 消耗硫酸的质量:甲>乙>丙
(5)在AgNO3、Zn(NO3)2 和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤。向滤渣中加入稀盐酸,有气泡产生。根据上述现象,下列说法正确的有______。
A 滤渣中一定有Zn
B 滤渣中一定有Ag和Fe,可能有Cu
C 滤液中一定有Fe(NO3)2、Zn(NO3)2
D 滤液中可能有AgNO3、Cu(NO3)2
【答案】Fe(或Al) 塑料或橡胶 隔绝氧气和水蒸气(或隔绝空气) ![]() C C
C C
【解析】
(1)铝合金是铝的合金,不锈钢是铁的合金,故含有的金属元素是:Al或Fe;
含有的有机合成材料是:塑料或橡胶;
(2)铁生锈的条件是铁与氧气、水接触,故防止铁生锈,可以隔绝氧气和水,如喷漆,故填:隔绝氧气和水蒸气(或隔绝空气);
(3)铝的化学性质比较活泼,在常温下,铝能与空气中的氧气反应,在其表面形成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化,铝与氧气反应生成三氧化二铝,该反应的化学方程式为:![]() ;
;
(4)A、金属越活泼,金属与酸反应的速率越快,由图可知,乙的反应速率最快,其次是甲,然后是丙,故三种金属的活泼性:乙>甲>丙,不符合题意;
B、由图可知,生成氢气的质量:甲>乙>丙,不符合题意;
C、等质量的金属与足量的稀硫酸反应生成氢气的质量=![]() ,反应后,甲、乙、丙三种金属均显+2价,质量相同,故相对原子质量:丙>乙>甲,符合题意;
,反应后,甲、乙、丙三种金属均显+2价,质量相同,故相对原子质量:丙>乙>甲,符合题意;
D、根据质量守恒定律,化学反应前后,元素的质量不变,故生成氢气的质量与参加反应的硫酸中的氢元素的质量相等,生成氢气的质量:甲>乙>丙,故消耗硫酸的质量:甲>乙>丙,不符合题意。
故选C;
(5)在AgNO3、Zn(NO3)2 和Cu(NO3)2的混合溶液中加入一定量的铁粉,铁先与硝酸银反应生成硝酸亚铁和银,待硝酸银完全反应后,铁再与硝酸铜反应生成硝酸亚铁和铜,在金属活动性顺序里,锌位于铁之前,铁不与硝酸锌反应,充分反应后过滤。向滤渣中加入稀盐酸,有气泡产生,说明铁粉剩余。
A、铁与硝酸锌不反应,故滤渣中一定不含锌,不符合题意;
B、铁粉过量,说明铁已经将硝酸银和硝酸铜完全置换,滤渣中一定含有铁、铜、银,不符合题意;
C、铁与硝酸银反应生成硝酸亚铁和银,铁与硝酸铜反应生成硝酸亚铁和铜,铁粉过量,铁已经将硝酸银和硝酸铜完全置换,铁与硝酸锌不反应,故滤液中一定含有硝酸锌和硝酸亚铁,符合题意;
D、铁粉剩余,铁已经将硝酸银和硝酸铜完全置换,故滤液中一定不含硝酸银和硝酸铜,不符合题意。
故选C。


 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:初中化学 来源: 题型:
【题目】 A、B、C、D、E是初中化学中常见物质。A、B是两种单质,D是蓝色溶液,E是世界产量最多的金属,它们之间的关系如图所示。试回答:
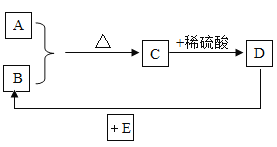
(1)A的化学式_____;
(2)写出D→B的化学方程式_____,属于_____反应(填基本反应类型)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验小组用传感器探究稀NaOH溶液与稀盐酸反应过程中温度和pH的变化,测定结果如图所示。下列说法不正确的是
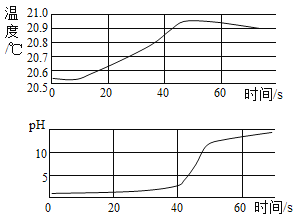
A.反应过程中有热量放出
B.30s时,溶液中溶质为HCI和NaCl
C.从20s到40s,溶液温度升高、pH增大
D.该实验是将稀盐酸滴入稀NaOH溶液中
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某班同学为验证碳酸钠的化学性质,向盛有碳酸钠的试管中加入一定量的稀盐酸,迅速用带导气管的橡胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中(如图所示)。请回答下列问题:
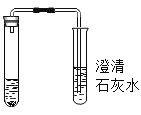
(1)右侧试管中澄清石灰水变浑浊,写出该反应的化学方程式_____。
(2)实验结束后,将两支试管中的所有物质倒入同一个废液缸中,充分反应后得到澄清溶液。同学们对废液中溶质的成分进行如下探究(忽略二氧化碳的影响):
(提出问题)
废液中溶质的成分是什么?
(做出猜想)
猜想一:CaCl2、NaCl和HCl
猜想二:CaCl2、NaCl和Na2CO3
猜想三:_____;
(进行讨论)
经过讨论,同学们一致认为猜想_____是错误的。
(设计实验)请完成实验报告
实验步骤 | 实验现象 | 实验结论 |
取少量废液于试管中,加入_____; | _____。 | 猜想一成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某种铁的冶炼流程如下图所示。
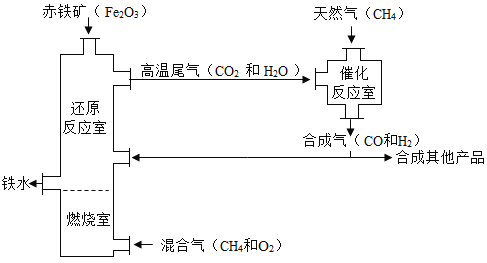
(1)整个流程中,化合价发生改变的元素有_______种。
A 3 B 1 C 4 D 2
(2)若用CO还原含160tFe2O3的赤铁矿,则炼出铁的质量为_______t。
A 112 B 56 C 140 D 28
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明同学在练习“金属的化学性质”实验操作时,发现几支试管中气泡产生的速率有快有慢,于是他与小芳同学一起合作进行如下探究。
(提出问题)金属与酸反应的快慢受哪些因素影响呢?
(猜想与假设)猜想一:可能与酸的浓度有关;
猜想二:可能与金属的种类有关;
猜想三:可能与金属的形状有关。
(设计并进行实验 )为了验证猜想,小明和小芳设计下图所示装置进行实验。
编号 | 盐酸的浓度(均取20 mL) | 金属(均取2g) | 金属的形状 | 收集50 mL氢气所需时间/s |
① | 10% | 铝 | 粉状 | 70 |
② | 10% | 铁 | 片状 | 120 |
③ | 10% | 铝 | 片状 | 112 |
④ | 20% | 铁 | 片状 | 110 |
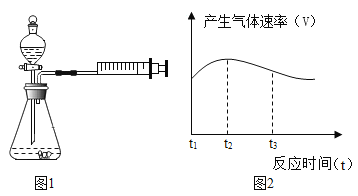
(1)小明和小芳检查图1装置气密性的方法是:关闭分液漏斗活塞,用力将注射器活塞向右移动一 段距离,停止用力后松手,若观察到_________________,则表示气密性良好。
(2)写出铝与盐酸反应的化学方程式:____________________________________。
(收集证据)
(3)要比较金属的形状对反应快慢的影响,应选择的实验编号是________________________。
(得出结论)
(4)通过上述四个实验,你得出的影响金属与酸反应的快慢因素有________________________。
(5)实验①中试管外壁发烫,说明铝与盐酸的反应是放热反应,实验测得该反应中产生气体的速率(v)与时间(t)的关系如图2所示,你认为在t2~t3时间段内反应速率逐渐减慢的主要原因是____________________。
(实验拓展)
(6)小明将盐酸换成稀硫酸继续进行实验,发现铝粉和稀硫酸的反应现象不明显。为什么铝粉易与盐酸反应而难与稀硫酸反应呢?小明认为可能是Cl-的存在使酸和铝的反应容易进行。请你帮助小明设计一个合理的实验来验证假设:___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学学习兴趣小组为了测定某生理盐水的溶质质量分数,实验过程和有关实验数据如图所示:

根据上图信息解决下列问题:
(1)已知过滤后获得的固体物质是一种纯净物,则该物质的名称是____________,质量是__________g。
(2)该生理盐水的溶质质量分数是多少?(写出运算过程)________________
(3)请在图上作出往生理盐水滴加 AgNO3 溶液, 产生 AgCl 沉淀的质量与参与反应的 AgNO3 溶液的质量之间的关系图像。__________
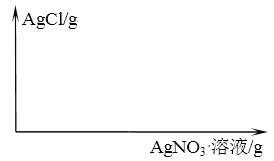
(4)已知硝酸钠的溶解度如表所示,据此估算判断该实验获得的 161.13g 溶液在常温下属于___________________溶液(填“饱和”或“不饱和”)。
硝酸钠在水中的溶解度
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
溶解度/g | 73 | 80 | 87 | 98 | 103 | 113 | 124 | 137 | 150 | 163 | 180 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是初中化学实验室制取和收集气体的一些常见装置,请你回答下列有关问题:
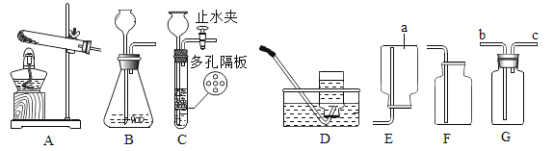
(1)装置图中仪器a的名称为_______________________。
(2)采用加热氯酸钾和二氧化锰的混合物制取氧气,可选用的发生装置是_______________________,该反应的化学方程式为_______________________; 若收集一瓶氧气, 供铁丝在氧气中燃烧的实验使用,选择的收集装置为_______________________。
(3)若用G装置装满水收集氢气,氢气应从_________________进(选“b”或“c”)。
(4)实验室制CO2若用C装置代替B装置CO2,优点是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com