
分析 (1)铁与稀硫酸反应生成硫酸亚铁和氢气,根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量.
(2)由生成氢气的质量,由反应的化学方程式列式计算出参加反应的铁的质量,进而计算出该生铁中铁的质量分数.
解答 解:(1)根据质量守恒定律,反应生成氢气的质量是23g+160g-182.2g=0.8g.
(2)设参加反应的铁的质量为x
Fe+H2SO4=FeSO4+H2↑
56 2
x 0.8g
$\frac{56}{2}=\frac{x}{0.8g}$ x=22.4g
该生铁中铁的质量分数为$\frac{22.4g}{23g}$×100%≈97.4%.
答:(1)0.8;(2)该生铁中铁的质量分数为97.4%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.


科目:初中化学 来源: 题型:选择题
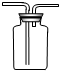 如图所示装置在化学实验中常用于洗气、储气、收集气体等.
如图所示装置在化学实验中常用于洗气、储气、收集气体等.| A. | ①②③④ | B. | 只有②③④ | C. | 只有①②③ | D. | 只有①③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 事 实 | 解 释 |
| A | 盐酸、稀硫酸都能使紫色石蕊试液变红 | 它们所含的阳离子全部都是H+ |
| B | 鱼、虾能在水中生存 | 氧气易溶于水 |
| C | 活性炭用于防毒面具 | 活性炭具有吸附性 |
| D | 食盐是咸的,白糖是甜的 | 不同种物质的分子性质不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
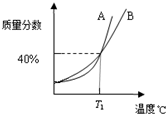 如图是A、B两种物质饱和溶液的溶质质量分数随温度变化的曲线.现分别向50克A和80克B固体中各加水150克,加热溶解,同时蒸发掉50克水,冷却至T1℃,这时( )
如图是A、B两种物质饱和溶液的溶质质量分数随温度变化的曲线.现分别向50克A和80克B固体中各加水150克,加热溶解,同时蒸发掉50克水,冷却至T1℃,这时( )| A. | 二者均有晶体析出 | B. | 只有A析出有晶体析出 | ||
| C. | 只有B析出有晶体析出 | D. | A物质的溶解度大于B物质的溶解度 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 次 数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 8.5 | 7 | 6.6 | 6.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com