

| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
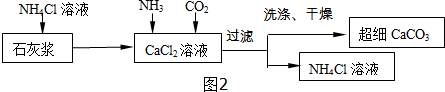
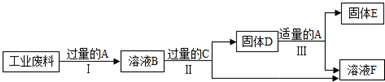
分析 Ⅰ.过滤能够把不溶于水的固体从液体中分离出来;
过滤时需要的玻璃仪器有烧杯、玻璃棒、漏斗;
玻璃棒的用途有引流、搅拌、转移物质等;
相同条件下,物质的溶解度越小,越容易从溶液中析出;
氯酸钾能够溶于KCl饱和溶液和冰水,不溶于饱和KClO3溶液;
Ⅱ.氯化钙、水、二氧化碳、氨气反应生成碳酸钙沉淀和氯化铵;
氯离子能和银离子结合成白色沉淀氯化银.
解答 解:Ⅰ.(1)操作a的名称是过滤,在实验室中完成此操作需要的玻璃仪器有烧杯、玻璃棒、漏斗,该操作中玻璃棒的作用是引流.
故填:过滤;漏斗;引流.
(2)反应2为复分解反应,即氯酸钙和氯化钾反应生成氯酸钾和氯化钙,则溶液A中含有的溶质为CaCl2和KClO3;
该反应能得到KClO3晶体的原因是相同条件下,氯酸钾的溶解度最小.
故填:KClO3;相同条件下,氯酸钾的溶解度最小.
(3)氯酸钾能够溶于KCl饱和溶液和冰水,不溶于饱和KClO3溶液,因此洗涤KClO3晶体时,可选用下饱和KClO3溶液.
故填:C.
Ⅱ.(1)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式为:CaCl2+H2O+CO2+2NH3═CaCO3↓+2NH4Cl;
该流程可循环使用的物质是氯化铵溶液.
故填:CaCl2+H2O+CO2+2NH3═CaCO3↓+2NH4Cl;氯化铵溶液.
(2)检验CaCO3是否洗涤干净的方法是:取最后一次洗涤液,向其中滴加硝酸银溶液,如果产生白色沉淀,说明没有洗涤干净,如果不出现白色沉淀,说明已经洗涤干净.
故填:B.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:解答题
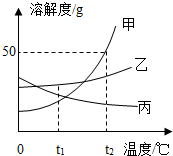 如图是甲、乙、丙三种物质的溶解度曲线,请回答下列问题:
如图是甲、乙、丙三种物质的溶解度曲线,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com