
| 第1次 | 第2次 | |
| 加入稀硫酸的质量/g | 200 | 200 |
| 烧杯内物质的质量/g | 212.5 | 412.25 |
分析 (1)根据表中的数据对比分析结合质量守恒定律求解生成氢气的质量;
(2)根据质量守恒,13g样品加入200g稀硫酸,生成氢气的质量为 200g+13g-212.5g=0.5g,再加入200g稀硫酸,生成氢气的质量为212.5g+200g-412.25g=0.25g.
(3)根据氢气的质量计算镁的质量
(3)根据第1次稀硫酸中中溶质的质量;根据计算结果和混合前后溶质的质量不变计算.
解答 解:(1)由表中甲、丙的数据可知,生成氢气的总质量为400g+13g-412.25g=0.75g.
(2)13g样品加入200g稀硫酸,生成氢气的质量为 200g+13g-212.5g=0.5g,加入400g稀硫酸,生成氢气的质量为400g+13g-412.25g=0.75g.说明第1次反应硫酸完全反应,剩余物为铜和镁;每消耗200g稀硫酸生成氢气为0.5g,第2次反应生成的氢气的质量为0.25g,所以硫酸过量,镁完全反应,剩余物为铜.故选:①④;
(3)设镁的质量为x
Mg+H2SO4═MgSO4+H2↑
24 2
x 0.75g
$\frac{24}{x}=\frac{2}{0.75g}$
解得:x=9g
铜镁合金样品中铜的质量分数为$\frac{13g-9g}{13g}×100%$≈30.8%,
(3)200g稀硫酸中溶质的质量为y
Mg+H2SO4═MgSO4+H2↑
98 2
y 0.5g
$\frac{98}{y}=\frac{2}{0.5g}$
y=24.5g
则400g上述稀硫酸中硫酸的质量为24.5g×2=49g,
设配制400g上述稀硫酸,需98%浓硫酸z,
98%×z=49g
z=50g,
需要水的质量为:400g-50g=350g;
故答案为:(1)0.75;(2)①④;(3)铜镁合金样品中铜的质量分数为30.8%,(4)350.
点评 本题难度一般,但综合性强,以信息给予题的形式考查了金属的化学性质、质量守恒定律的应用等,完成此题可以依据已有的知识进行.


科目:初中化学 来源: 题型:选择题
| A. | 过量排放CO2会造成酸雨 | |
| B. | 白色污染是指白色的垃圾污染 | |
| C. | 为改善环境质量应全面禁止农药化肥的使用 | |
| D. | 限制生产和使用含磷洗衣粉可以减少对水体的污染 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 试剂 | 操作 |
| A | Cu(NO3)2溶液 | AgNO3 | Cu | 过滤 |
| B | Na2CO3 | NaOH | 盐酸 | 结晶 |
| C | Fe | Cu | 稀硫酸 | 过滤 |
| D | CO2 | HCl | NaOH溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
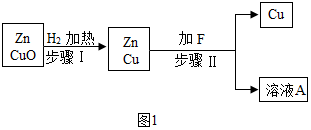
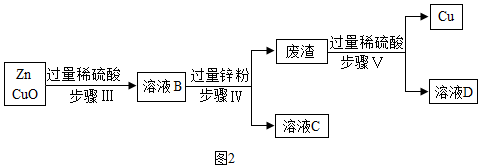
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 A-F是初中化学常见的六种物质,其中B常温下是一种常见的气体,E是世界年产量最大的金属,F是一种红色单质.物质间的转化关系如图(图中“→”表示转化关系,“-”表示相互能反应,部分反应物、生成物及反应条件已略去).请回答:
A-F是初中化学常见的六种物质,其中B常温下是一种常见的气体,E是世界年产量最大的金属,F是一种红色单质.物质间的转化关系如图(图中“→”表示转化关系,“-”表示相互能反应,部分反应物、生成物及反应条件已略去).请回答:查看答案和解析>>
科目:初中化学 来源: 题型:推断题
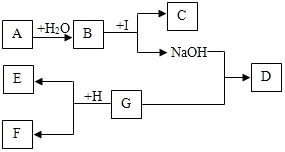 A-I为初中化学中常见的物质.已知A为金属氧化物,C为大理石的主要成分,D为蓝色沉淀,G、I均为只含有一种溶质的溶液.“→”表示物质间存在着相互转化的关系(部分生成物未标出),如图所示.
A-I为初中化学中常见的物质.已知A为金属氧化物,C为大理石的主要成分,D为蓝色沉淀,G、I均为只含有一种溶质的溶液.“→”表示物质间存在着相互转化的关系(部分生成物未标出),如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com