
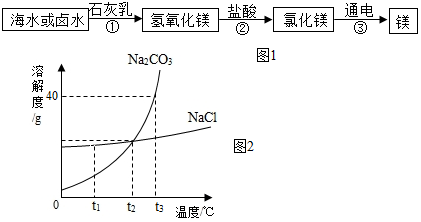
分析 (1)根据过滤只能将不溶性杂质从溶液中分离进行分析;
(2)根据氯化钠的溶液溶解度受温度影响变化不大进行分析;
(3)①根据氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙进行分析;
②根据从海水屮提取MgCl2时.经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程是将海水中的镁离子提取出来,富集镁离子进行分析;
(4)根据我国著名化学家侯德榜先生创立了“联合制减法”(即侯氏制碱法),以食盐为主要原料制取碳酸钠进行分析;
(5)根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)过滤只能将不溶性杂质从溶液中分离,不能从海水中得到淡水,蒸馏、结晶脱水、蒸发结晶可以从海水中得到淡水,故选:A;
(2)氯化钠的溶液溶解度受温度影响变化不大,所以从海水中提取食盐的基本方法是蒸发结晶;
(3)①氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,化学方程式为:MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,该反应属于复分解反应;
②海水中含有氯化镁,氯化镁溶解在海水中,不能直接提取出来,经历了“MgCl2→Mg(OH)2→MgCl2”的转化过程富集MgCl2,得到纯净的氯化镁,然后电解才能得到镁;
(4)我国著名化学家侯德榜先生创立了“联合制减法”(即侯氏制碱法),以食盐为主要原料制取碳酸钠;
(5)①A、通过分析溶解度曲线可知,t1℃时,Na2CO3溶解度小于NaCl溶解度,故A错误;
B、t2℃时,碳酸钠和氯化钠的溶解度相等,所以饱和Na2CO3溶液与饱和NaCl溶液溶质质量分数相等,故B正确;
C.t3℃时,碳酸钠的溶解度是40g,所以100g水中最多溶解40gNa2CO3,故C错误;
D.氯化钠的溶解度曲线较碳酸钠的溶解度曲线平缓,所以NaCl的溶解度受温度变化的影响比Na2CO3的小,故D错误.
故选:B;
②t3℃时,碳酸钠的溶解度是40g,所以将25gNa2CO3固体放入50g水中,充分溶解后,可得到Na2CO3的饱和溶液,所得溶液的质量为70g;
③碳酸钠的溶解度随温度的升高而增大,所以能将饱和Na2CO3溶液变为不饱和溶液的是加水,升温,故选:BE;
④将t2℃时等质量的饱和NaCl和Na2CO3溶液降温至t1℃,碳酸钠析出的晶体较多,所以所得溶液的质量关系:NaCl溶液质量>Na2CO3溶液质量;
⑤生活在盐碱湖附近的人们“夏晒盐,冬捞碱”,说明谚语中“冬捞碱”的原理:碳酸钠的溶解度受温度的影响比较大,因此通过降温结晶得到碳酸钠.
故答案为:(1)A;
(2)蒸发结晶;
(3)①MgCl2+Ca(OH)2=CaCl2+Mg(OH)2↓,复分解;
②富集氯化镁,得到纯净的氯化镁;
(4)侯德榜,碳酸钠;
(5)①B;
②饱和,70;
③BE;
④>;
⑤碳酸钠的溶解度受温度的影响比较大,因此通过降温结晶得到碳酸钠.
点评 本题考查的知识较多,难度较大,需要逐题分析,然后结合学过的知识进行解答.


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 |  |  |  |
| A | B | C | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com