
| 金属 | Ti | Mg | Ag |
| 反应现象 | 反应缓慢 | 反应强烈 | 无明显现象 |
分析 【实验设计】
金属长期暴露在空气中时,可能被空气中的氧气氧化;
【实验结论】
根据实验现象可以判断实验结论;
反应速率和反应物浓度有关,即反应物浓度越大,反应速率越快;
铁和硫酸天反应生成硫酸亚铁和铜.
解答 解:【实验设计】
三种金属加入盐酸前都先用砂纸将表面擦光亮,其目的是除去表面的附着物.
故填:除去表面的附着物.
【实验结论】
原假设中a不正确,理由是:Ti和稀盐酸反应不如Mg和稀盐酸反应强烈,因此Ti的金属活动性比Mg弱.
故填:a;Ti的金属活动性比Mg弱.
[结论]
用不同浓度的足量稀盐酸反应,不能得出同样结论,这是因为反应速率与反应物浓度有关.
故填:不能;反应速率与反应物浓度有关.
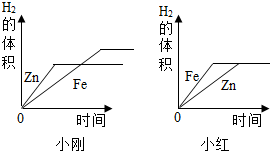
(1)两个图象中存在有错误的是小红的图象,判断错误的理由是Zn的反应速率较Fe快,因此图象中Fe与Zn标反了;
图象不同的原因是:小刚取的金属量较少,金属完全反应,而小红取的酸量较少,酸完全反应.
故填:小红;Zn的反应速率较Fe快,因此图象中Fe与Zn标反了;小刚取的金属量较少,金属完全反应,而小红取的酸量较少,酸完全反应.
①金属与酸反应的速率与金属活动性有关.
故填:金属活动性.
②金属与酸反应中若生成盐中金属价态相同,则生成的氢气量与相对原子质量有关.
故填:相对原子质量.
(2)将铁粉加到硫酸铜溶液中,可能观察到的现象有产生红色固体,溶液由蓝色变成浅绿色.
故填:产生红色固体,溶液由蓝色变成浅绿色.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 (1)天然水中含有的部分杂质如表所示:
(1)天然水中含有的部分杂质如表所示:| 溶 解 物 质 | 悬浮物质 | ||
| 主要气体 | 主要离子 | 生物生成物 | 细菌、藻类及原生 物、泥沙、黏土等 |
| 氧气 二氧化碳 硫化氢等 | 钙离子、氯离子、 硫酸根离子、镁离子 | NH4+、NO2-、 HPO42-、Fe3+、 H2PO4-等 | |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
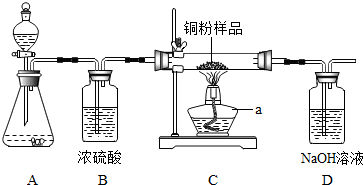
| 实验方案 | 实验现象 | 分析及结论 |
| 实验一:将带火星的木条伸入盛有5mL5%H2O2溶液的试管 | 带火星木条不复燃 | H2O2溶液常温下产生氧气的量很少,不足以使带火星的木条复燃 |
| 实验二:向盛有5mL5%H2O2溶液的试管中加入1gCuO固体,将一根带火星的木条伸入试管,观察现象.待反应结束后将试管里的剩余物进行过滤、洗涤、干燥、称量.对比反应前后CuO的质量 | 带火星的木条复燃. 称得固体质量为1g | 猜想Ⅰ成立.反应前后固体的质量相等 |
| 实验三:向盛有5mL5%H2O2溶液的试管中加入1g铜,将带火星的木条伸入试管,观察现象 | 没有气泡产生,带火星木条不复燃 | 猜想Ⅱ不成立(填”成立“或“不成立”) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com