
下图是NaCl、MgSO4的溶解度曲线。下列说法正确的是

A.只有在t1℃时,NaCl和MgSO4的溶解度才相等
B.t1℃~t2℃,MgSO4的溶解度随温度升高而增大
C.在t2℃时,MgSO4溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出
C
解析:A、根据两物质的溶解度曲线不难看出,两物质的溶解度曲线有两个交点,即t1℃和t3℃时,两物质的溶解度相等,故A错误;
B、由硫酸镁的溶解度曲线可知,在t2℃~t3℃时,硫酸镁的溶解度先随温度的升高而减小,故B错误;
C、在t2℃时,由于硫酸镁的溶解度最大,根据饱和溶液中溶质的质量分数和溶解度间的关系:溶解度/( 100+溶解度) ×100%.所以硫酸镁在该温度的饱和溶液中溶质的质量分数大,故C正确;
D、由于在t2-t3℃,硫酸镁的溶解度随温度的降低而增大,因此把MgSO4饱和溶液的温度从t3℃降至t2℃时,溶液会由饱和溶液变成不饱和溶液,而不会有晶体析出,故D错误;
故选C.


科目:初中化学 来源: 题型:
| 碘 盐 配料:氯化钠、碘酸钾(KIO3) 含碘量:(20~30)mg/kg 净重:500克 食用方法:勿长时间炖炒 贮藏指南:避光、避热、密封防潮(1)碘酸钾(KIO3)中碘元素的化合价为 +5 .氯化钠的化学式为NaCl .(2)根据碘盐的贮藏指南,推测碘酸钾的一种化学性质是 受热易分解 .(3)防核辐射最有效的方法是每天服用一片碘片,因为每片碘片中含有100毫克的碘,如果通过吃碘盐来补充等量的碘,请计算,一天至少需要吃 4 包碘盐.(取整数).
查看答案和解析>> 科目:初中化学 来源: 题型: 19、我市正在建设海水淡化厂.下图是小红制作的海水综合利用图,请填空:  (1)海水中还有一种最重要的物质没有在上图中列出,其化学式为: H2O .(2)选择上图中的物质,将其化学式填入下表(各举一例):
Mg+2HCl═MgCl2+H2↑ ;(4)我市年人均水量为871m3,只有全国年人均的40%,福建省年人均的25%,远低于国际年人均水资源的警戒线1700m3,有专家建议我市可从空中和海水中获得水资源; ①从空气中取水是 物理 (填“物理”或“化学”)变化,理由是没有生成新物质 ;②从海水淡化厂排出的高浓度盐溶液也是污染物,你认为应该如何处理: 提取出用的物质进行综合利用 .查看答案和解析>> 科目:初中化学 来源: 题型:阅读理解 10、海水是一种化学成分复杂的混合物,包括水、溶解于水中的多种化学元素和气体.在海水中迄今已发现的化学元素达80多种.含量较高的元素除组成水的氢、氧元素外,还有氯、钠、镁、硫、钙、钾、溴、碳、锶、硼、氟等. (1)以海水及其产品为原料可以生产许多化工产品,如氯化钠、氢气、氢氧化钠、氯气、钠、镁、食用加碘盐等. ①请根据你学过的化学知识,按照纯净物、单质、混合物、化合物,将海水、氢气、氯化钠、氯气、氢氧化钠、钠、镁、食用加碘盐进行分类.(要求用框图的形式表示,层次分明) 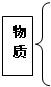 ②在氯化钠、氢气、镁三种物质中,由分子构成的是 氢气(H2) ;由原子构成的是镁(Mg) ;由离子构成的是氯化钠(NaCl) .(2)自然界中的溴元素绝大多数存在于海洋中,其元素符号为Br,根据中文名称猜测溴应属于 非金属 (填“金属”或“非金属”)元素,该元素位于元素周期表右侧 (填“左侧”、“右侧”或“中部”).(3)锶是一种重要的金属元素,其原子结构示意图和在元素周期表中显示的信息见下图,请回答有关问题: 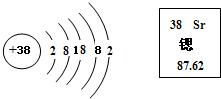 ①锶原子核外的电子层数为 5 ,原子核内质子数为38 ;在化学反应中易失去 (填“得到”或“失去”)电子②锶元素的原子序数为 38 ,其相对原子质量为87.62 ;(4)海水也是未来人类生活用水的重要来源.小明同学从水产市场带回一瓶浑浊的海水,准备与同学们一起对其进行净化.请你参入他们的实验并回答有关问题. ①他们在向水中加入明矾,搅拌静置后进行过滤,加入明矾的目的是 使水中悬浮的杂质沉降 ; 过滤需要的主要仪器和用品有铁架台(带铁圈)(或漏斗架)、漏斗、玻璃棒、烧杯、滤纸 ;②下列对过滤过程及结果描述正确的是 ABC (填编号);A.此过程发生的是物理变化 B.过滤是利用颗粒大小不同将混合物分离 C.过滤之后得到的“水”仍是咸的 D.过滤之后得到的“水”可以饮用 ③证明过滤之后得到的“水”中仍含有杂质的方法是 滴几滴水样于玻璃片上,放在酒精灯上加热,观察现象 ;④小明想把海水制成蒸馏水,他应该进行的操作是 蒸馏 ,一般不用蒸馏水作为饮用水的理由是蒸馏水中不含人体所需的多种矿物元素,长期饮用会影响健康 .(5)海水是一种溶液,其中溶剂是水,溶质有多种,海水中溶质的质量分数约为3.5%,市场上销售的“海水精”是根据海水溶质的主要成分按比例混合而成,“海水精”是一种白色固体,易溶于水.若用“海水精”配制一定量的人造海水,请回答有关问题: ①配制步骤依次为 计算、称量(量取)、溶解 ;②所需要用到的主要仪器是 托盘天平、量筒、药匙、玻璃棒、胶头滴管、烧杯 .查看答案和解析>> 科目:初中化学 来源: 题型:阅读理解 我国科学家侯德榜为我国纯碱和氮肥工业技术的发展做出了杰出的贡献.下图是侯氏联合制碱法和西方索尔维制碱法的工艺流程.已知有关物质重要反应的化学方程式如下: 2NH4Cl+X═2NH3↑+CaCl2+2H2O NH4Cl
 根据以上信息回答下列问题. (1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的MgCl2沉淀除去,可以向其中加入过量的烧碱.此时反应的化学方程式为 MgCl2+2NaOH═Mg(OH)2↓+2NaCl MgCl2+2NaOH═Mg(OH)2↓+2NaCl ,将混合液中不溶物除去的实验方法是过滤 过滤 ;溶液中多余烧碱可以加稀盐酸 稀盐酸 (填试剂名称)来除去,反应的化学方程式为NaOH+HCl═NaCl+H2O NaOH+HCl═NaCl+H2O .(2)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通入二氧化碳气体,溶液中会有碳酸氢钠晶体析出.试分析该流程需要“加压”的原因是: 增大二氧化碳的溶解度,使反应更充分 增大二氧化碳的溶解度,使反应更充分 .(3)在氨碱工业的历史上,如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”,即在氯化铵溶液中加入物质X Ca(OH)2 Ca(OH)2 (填化学式),产生了可循环使用的氨气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化铵的溶解度 溶解度 ,使氯化铵晶体单独析出得到另一种产品--氮肥.氯化钠溶液则可以循环利用.(4)在氨碱工业处理剩余的氯化铵溶液时.为何不直接蒸发结晶析出氯化铵固体? 答: 氯化铵受热易分解 氯化铵受热易分解 .查看答案和解析>> 科目:初中化学 来源: 题型: 学校化学兴趣小组对一包粗盐进行提纯,并用粗盐提纯后的氯化钠来配制一定质量分数的NaCl溶液. (1)粗盐中含有MgCl2、CaCl2以及泥沙等杂质,为了有效将粗盐提纯,实验的各步操作流程如下图所示,请回答:  ①在完成操作Ⅰ之前,必须加入的X物质是 水 水 .②操作Ⅰ和操作Ⅱ的名称是 过滤 过滤 .③在实验过程中加入过量的NaOH溶液,其实验目的是 除尽氯化镁 除尽氯化镁 ,有关化学方程式是MgCl2+2NaOH=Mg(OH)2↓+2NaCl MgCl2+2NaOH=Mg(OH)2↓+2NaCl .④实验所得精盐的质量大于粗盐中NaCl的质量,原因是 在粗盐提纯的过程中有氯化钠生成 在粗盐提纯的过程中有氯化钠生成 .(2)老师拿出实验后回收的氯化钠溶液,请同学们测定其溶质的质量分数.经过讨论,大家决定利用以下两种方法: ①蒸发结晶法:取一定量的氯化钠溶液,将其倒入蒸发皿中,加热蒸发,得到食盐晶体.多次测量计算所需的各个物理量后,数据如下表所示:
②化学沉淀法:取20g 氯化钠溶液,倒入烧杯中,然后滴加溶质质量分数为17%的硝酸银溶液,反应完全时消耗硝酸银溶液的质量为34.2g.计算用该方法测得的氯化钠溶液的溶质质量分数. 查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |