
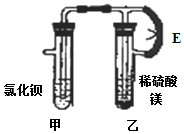
 科学是一门以实验为基础的学科.某兴趣小组开展了如图所示的研究,他们把甲乙装置按图连接,先打开止水夹E,反应片刻后夹紧止水夹E.
科学是一门以实验为基础的学科.某兴趣小组开展了如图所示的研究,他们把甲乙装置按图连接,先打开止水夹E,反应片刻后夹紧止水夹E.分析 根据稀硫酸与镁反应能生成氢气和硫酸镁,硫酸根离子和钡离子反应生成硫酸钡沉淀,以及装置内气压变化情况分析相关现象.
解答 解:稀硫酸与镁反应能生成氢气和硫酸镁可知:打开止水夹E,甲试管中可以观察到的现象是:甲试管中导管下端产生气泡;夹紧止水夹K后,乙试管中的气体把试管中的液体压入甲试管,使得硫酸镁溶液与氯化钡溶液反应产生硫酸钡沉淀.
故答案为:导管下端产生气泡;
出现白色沉淀,夹住止水夹K后,稀硫酸和镁反应生成的氢气使乙装置内的压强增大,将稀硫酸、硫酸镁压入甲装置内,硫酸根离子和钡离子反应生成硫酸钡沉淀.
点评 本题考查利用课本知识解决新问题能力,能加深学生对课本知识的理解,训练学生的思维能力.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 家用电器着火时,应立即用水浇灭 | |
| B. | 煤气泄漏时,应立即关闭阀门,开窗通风 | |
| C. | 洒出的酒精在桌上燃烧时,应立即用湿抹布扑盖 | |
| D. | 发生火灾时,应立即拨打119火警电话,并采取必要的自救措施 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
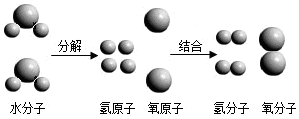
| A. | 水电解是化学变化 | B. | 分子由原子构成 | ||
| C. | 水电解前后原子的种类没有变化 | D. | 水分子是由氢分子和氧分子构成 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
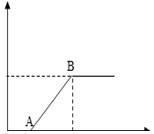 下表中的选项符合图所示的曲线的是( )
下表中的选项符合图所示的曲线的是( )| 选项 | 横坐标 | 纵坐标 |
| A | 某温度下,向接近饱和的氯化钠溶液中加入氯化钠晶体 | 溶液中溶质的质量分数 |
| B | 向碳酸钠和碳酸钾混合溶液中加入稀盐酸的质量 | 产生气体的质量 |
| C | 向一定量的澄清石灰水和氢氧化钡混合溶液中加入碳酸钠溶液的质量 | 生成沉淀的质量 |
| D | 向氯化铁和盐酸的混合溶液中加入过量氢氧化钠溶液 | 生成沉淀的质量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
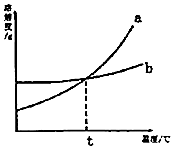 如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )
如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )| A. | a物质的溶解度受温度的影响比b物质小 | |
| B. | t℃时,a、b饱和溶液中含有相同质量的溶质 | |
| C. | t℃时,a的饱和溶液升温,溶质的质量分数变大 | |
| D. | a中含有少量b时,用冷却热饱和溶液的方法提纯a |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
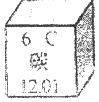
| A. | 核外电子数为12 | B. | 碳原子核内质子数为12 | ||
| C. | 核外电子数为6 | D. | 碳的相对原子质量为12.01g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
| 实验操作 |  | 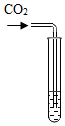 |  |
| 实验现象 | 溶液变为蓝色 | 溶液变浑浊 | 产生白色沉淀 |
| 实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com