
【题目】下列字母A~F表示初中化学常见的物质,它们由氢、碳、氧、氯、钠、钙、铁中的一种或几种元素组成,其中D、E、F均由三种元素组成。
(1)A能进行光合作用,被称为气体肥料,A的化学式为_________。
(2)B是胃酸的主要成分,可与C发生反应,得到黄色溶液,反应的化学方程式为________。
(3)D可与B发生反应,但无明显实验现象,其反应的化学方程式为__________________。
(4)用B、E、F完成如下图所示实验。
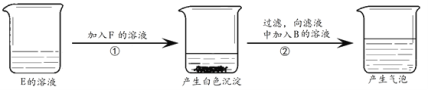
用化学方程式表示产生白色沉淀的原因________;原滤液中溶质的组成是________。
【答案】CO2 6HCl + Fe2O3=2FeCl3 + 3H2O NaOH + HCl=NaCl + H2O Ca(OH)2 + Na2CO3 =CaCO3↓+ 2 NaOH Na2CO3和NaOH
【解析】
(1)A能进行光合作用,被称为气体肥料,A为二氧化碳,化学式为CO2;
(2)B是胃酸的主要成分,B为盐酸,可与C发生反应,得到黄色溶液,C是氧化铁,反应的化学方程式为6HCl + Fe2O3=2FeCl3 + 3H2O;
(3)碱的溶液和酸反应时常无明显现象,D可与B发生反应,但无明显实验现象,应该是氢氧化钠和盐酸的反应,其反应的化学方程式为NaOH + HCl=NaCl + H2O;
(4)氢氧化钙和碳酸钠反应产生白色沉淀碳酸钙,化学方程式为:Ca(OH)2 + Na2CO3 =CaCO3↓+ 2 NaOH;反应后滤液中溶质可能为:氢氧化钠或氢氧化钠和碳酸钠或氢氧化钠和氢氧化钙,加入盐酸后有气泡产生,说明有碳酸钠,原滤液中溶质的组成是氢氧化钠和碳酸钠。


科目:初中化学 来源: 题型:
【题目】金属具有广泛的应用.
(1)2017年4月23日,我国首架大型客机C919飞机在上海浦东机场进行高滑抬前轮试验,为C919的首飞打下坚实基础.如图1所示,飞机大量使用了金属材料,用钛合金制作飞机主要是因为钛合金_____(填序号).

A熔点高 B密度大 C抗腐蚀性能好
(2)同学们设计了如图2所示的实验,证明金属活动性顺序是Zn>H>Cu>Ag,则溶液A和溶液B分别是_____、_____.
(3)将一定量的锌和铝投入到硝酸银和硝酸铜的混合溶液中,充分反应后过滤,得滤渣和滤液.将滤渣洗涤、干燥,取滤渣滴加稀盐酸,无气泡产生,则滤渣中可能含有的物质的化学式是_____;取滤液滴加氯化钠溶液,无明显现象,则滤液中可能含有的溶质的化学式是_____.
(4)工业上,用一氧化碳和赤铁矿(主要成分是氧化铁)炼铁的化学方程式为_____,计算含氧化铁160t的赤铁矿,理论上能冶炼出铁的质量为_____t.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验室要从含少量铜粉的银、锰混合金属粉末中分离出贵金属,并获得一种盐晶体。将这三种金属随意编号为:A、B、C,并设计了如图1所示流程:

(1)A、B、C三种金属的活动性由强到弱顺序为____________(用元素符号表示)。活泼金属将不活泼金属从溶液中置换出来,实质上是电子在原子和离子间的转移,图2中用“o”表示电子在铁原子和铜离子间移动,则电子的移动方向是________(填序号,“①从铁原子到铜离子”或“②从铜离子到铁原子”)。
(2)写出上述实验中产生的无色气体的一种用途__________________。进行蒸发时,观察到蒸发皿内_______________,停止对蒸发皿进行加热。
(3)金属B与硝酸银反应的化学方程式为____________________。除了用活泼金属外,判断滤液中是否有硝酸银剩余的方法是____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文(原文作者:许谦,有删改)
酸奶口感酸甜,营养丰富,是深受人们喜爱的一种乳制品。与普通牛奶比较,酸奶中的蛋白质和钙更易被人体消化吸收,是乳糖不耐症患者的良好食品。
通常的酸奶是将牛奶发酵而制成的。牛奶中主要含有蛋白质、乳糖和脂肪。在发酵过程中,乳酸菌把乳糖(C12H22O11)转化成乳酸(C3H6O3),使得牛奶的酸度升高。随着酸度增加,蛋白质分子互相连接,形成了一个巨大的“网络”,这个“蛋白质网络”把乳糖、水、脂肪颗粒都“网”在其中。所以,奶变“粘”、变“酸”了。

酸奶中含有大量活力较强的乳酸菌。乳酸菌可抑制某些腐败菌和病原菌的繁殖,从而维持人体内,尤其是肠道内正常的微生态平衡,促进食物的消化吸收。酸奶在储藏和配送过程中,乳酸菌的数量会因乳酸的过量积聚而明显减少,而酸奶的乳酸积聚又会影响到酸奶的酸度。有研究者选取某种市面常见的酸奶进行实验,数据如下表所示。
表某品牌酸奶酸度的变化
温度/℃ 时间/天酸度/°T | 4 | 28 | 37 |
0 | 67.7 | 67.7 | 67.7 |
2 | 73.9 | 77.1 | 79.2 |
4 | 76.4 | 82.7 | 86.3 |
6 | 85.5 | 92.2 | 98.9 |
8 | 90.2 | 98.7 | 113.2 |
1999年颁布的国标GB2746-1999中,对成品酸奶的酸度规定为“酸度不小于70°T”。按照一般人的接受程度,酸奶酸度不能超过100°T。
依据文章内容回答下列问题。
(1)乳酸是由乳糖转化生成的,请比较二者的化学式,分析它们的相同点和不同点。
相同点:_____。
不同点:_____。
(2)实验中所用酸奶若在37℃条件下储存,_____天后,酸度一定会超出一般人的接受程度。(填字母序号,下同)
A 2 B 4 C 5 D 8
(3)由表中实验数据可知,影响酸奶酸度的因素有_____。
(4)下列关于酸奶的说法正确的是_____。
A 酸奶适用于乳糖不耐症患者食用
B 酸奶放置时间越长,乳酸菌含量越高
C 酸奶中的乳酸菌对人类身体有害无益
D 酸奶变“粘”与蛋白质分子相互连接形成巨大“网络”有关
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类的生产和生活都离不开金属。
(1)下列生活用品中,主要利用金属导热性的是__________(填字母)。

(2)工业上用一氧化碳和赤铁矿炼铁的原理是_____________。(用化学方程式表示)
(3)铁生锈的条件是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】M、N两种固体的溶解度曲线如图甲。40℃时,将等质量的M、N两种固体,分别加入到盛有100g水的烧杯中,充分搅拌后,现象如图乙,降温到20℃时,现象如图丙。

下列说法正确的是( )
A.烧杯a中加入的固体为N
B.40℃时烧杯a中溶液一定是饱和溶液
C.40℃时烧杯b和20℃时烧杯b中溶质质量不相等
D.40℃时烧杯a和20℃烧杯b中溶液的溶质质量分数相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲乙的溶解度曲线如图所示(不含结晶水)请回答下列问题:
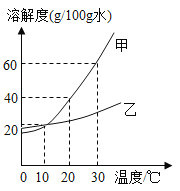
①0℃时,溶解度较大的物质是_____,20℃时,甲的溶解度是_____ g/100g水。
②10℃时将15g乙加入到50 g水中,充分搅拌后的溶液是_______(填“饱和”或“不饱和”),所得溶液的质量分数为_______(列式即可)。
③30℃时,将接近饱和的甲溶液变为饱和溶液的方法是_______(写一种即可)。
④某同学设计的鉴别甲乙固体的方案如下:30℃时,取6.0g甲和6.0g乙分别放入两只小烧杯中,各加入10mL水(水的密度为1g/mL),用玻璃棒充分搅拌后,观察现象.你认为此方案是否可行?并说明理由_______。
⑤甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,_______,_______,然后过滤。
⑥20℃时,将140g甲的饱和溶液蒸发掉50g水,再降温到10℃,可析出晶体的质量为_______克。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙、丁4种初中化学常见的物质,由氢、碳、氧、钠中的1~3种元素组成。 用如图所示装置和试剂做了以下3个连续实验。

已知:酚酞溶液遇Na2CO3溶液、NaHCO3溶液均呈红色。
(1)打开K,将胶头滴管中的水挤入集气瓶中,振荡集气瓶,观察到烧杯中的导管口有气泡冒出,触摸集气瓶壁,感觉到微热。
① 已知甲为白色固体,有强烈的腐蚀性,易潮解,则甲的化学式为_____。
② 烧杯中导管口有气泡冒出的原因是_____。
(2)关闭K,打开集气瓶塞,将少量黑色固体乙点燃后,立即伸入瓶中,塞紧瓶塞,观察到乙在丙中剧烈燃烧,发出白光。燃烧产物丁分子的微观示意图为![]() ,则丙分子的微观示意图为_____。
,则丙分子的微观示意图为_____。
(3)待乙充分燃烧至熄灭后,冷却至室温,振荡集气瓶后,打开K,观察到烧杯中的溶液沿导管进入集气瓶,瓶中产生大量气泡。
①烧杯中的溶液进入集气瓶后产生气泡的原因_____(用化学方程式解释)。
② 充分反应后,集气瓶内溶液为无色,则溶液中的溶质除酚酞、NaCl外,还可能有_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人类文明的发展和社会的进步同金属材料关系十分密切,其中钢铁是基本的结构材料,称为“工业的骨骼”。
(1)自行车的有些部件是由钢铁制成的。钢铁制品被腐蚀的原因,是其与_____接触引起的,为防止自行车链条生锈可采取的措施是_____。
(2)金属锂是密度最小的金属,用于原子反应堆、制轻合金及电池等。锂(Li)的原子结构示意如图1所示,它的化学性质与钠相似,原因是_____。请写出锂与稀硫酸反应的化学方程式:_____。
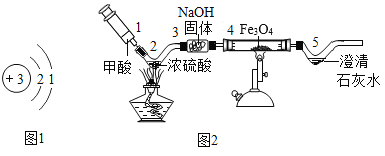
(3)同学们利用自制仪器模拟工业炼铁实验,用图2所示微型实验装置制取CO,然后用CO还原Fe3O4并检验气体产物。已知甲酸(HCOOH)具有挥发性,在热的浓硫酸中分解生成一氧化碳和水。
①位置4发生的化学方程式是_____。
②氢氧化钠固体的作用是什么?_____。
③本实验存在明显缺陷,请给出优化建议_____(写出一点即可)。
(4)工业上可利用铝和氧化铁在高温下发生置换反应制得铁来焊接钢轨。若用足量铝与40kg氧化铁反应,理论上可制得铁的质量是多少_____?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com