
| Ļą¶ŌŌ×ÓÖŹĮæ”ĮŌ×ÓøöŹż |
| Ļą¶Ō·Ö×ÓÖŹĮæ |
| 14 |
| 14+2+35.5 |



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
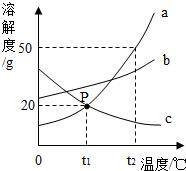 £Ø2013?µĀ»ŻŹŠ¶žÄ££©ČēĶ¼A”¢B”¢CČżÖÖ¹ĢĢåĪļÖŹµÄČܽā¶ČĒśĻߣ¬A”¢CĮ½ÖÖĪļÖŹČܽā¶ČĒśĻߵĽ»µćĪŖP£®»Ų“šĻĀĮŠĻą¹ŲĪŹĢā£ŗ
£Ø2013?µĀ»ŻŹŠ¶žÄ££©ČēĶ¼A”¢B”¢CČżÖÖ¹ĢĢåĪļÖŹµÄČܽā¶ČĒśĻߣ¬A”¢CĮ½ÖÖĪļÖŹČܽā¶ČĒśĻߵĽ»µćĪŖP£®»Ų“šĻĀĮŠĻą¹ŲĪŹĢā£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ŠņŗÅ | ¢Ł | ¢Ś | ¢Ū | ¢Ü |
| ĪļÖŹ | “×Ėį | ÉśŹÆ»Ņ | ŹģŹÆ»Ņ | “æ¼ī |
| »ÆѧŹ½ | CH3COOH | CaO | Ca£ØOH£©2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ||
| ||
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
| ||
| MnO2 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com