
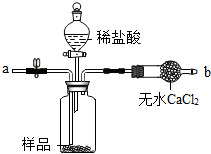
| A、铁皮未及时取出,会导致测定结果偏小 |
| B、铁皮未洗涤干净,会导致测定结果偏大 |
| C、烘干时间过长,会导致测定结果偏小 |
| D、若把盐酸换成硫酸,会导致测定结果偏大 |


科目:初中化学 来源: 题型:
 水和蛋白质均为人体必需的基本营养素.
水和蛋白质均为人体必需的基本营养素. ”表示碳原子,“
”表示碳原子,“ ”表示氮原子,“
”表示氮原子,“ ”表示氧原子,“
”表示氧原子,“ ”表示氢原子,“-或═”表示原子之间相互连接).则α-丙氨酸属于
”表示氢原子,“-或═”表示原子之间相互连接).则α-丙氨酸属于
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、酸能使紫色石蕊试液变红,CO2通入紫色石蕊试液会变红,所以CO2属于酸 |
| B、混合物中一定含有多种元素 |
| C、配制溶液时,搅拌的目的是增大溶质的溶解度 |
| D、溶液中有晶体析出时,溶质质量一定减小,而溶质的质量分数却不一定减小 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、氢氧化钠溶解度变小 |
| B、溶质的质量分数变小 |
| C、溶剂质量减小 |
| D、溶液变成不饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 步骤 | 实验操作 | 实验结果 |
| 1 | 取50克水,加入10gKNO3,搅拌,恢复到20℃ | 全部溶解,得溶液a |
| 2 | 再加5.8g KNO3,搅拌,恢复到20℃ | 恰好饱和,得溶液b |
| 3 | 再加10gKNO3,搅拌,恢复到20℃ | 得溶液c |
| 4 | 加热 | 全部溶解,得溶液d |
| 5 | 冷却到20℃ | 析出晶体,得溶液e |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| 序号 | 实验装置 | 主要实验步骤 | 实验结果 |
实验1 |  | ①读取反应前电子天平的示数(m1) ②将过量的稀盐酸全部倒入烧杯中 ③待反应停止后,立即读取电子天平的示数(m2) | 测得样品纯度的平均值为93.8% |
| 实验2 |  | ①在气密性良好的装置中装入药品 ②称量反应前烧杯和烧杯中液体的质量(m3) ③迅速加入过量的稀盐酸 ④待反应停止后,立即称量烧杯和烧杯中液体的质量(m4) | 测得样品纯度的平均值为25.0% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com