
| A. | pH=7 | B. | pH=1 | C. | pH=0 | D. | pH=14 |
科目:初中化学 来源: 题型:解答题
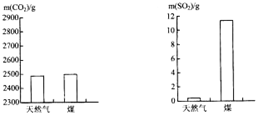
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 化学就在我们身边,它与我们的生活息息相关.
化学就在我们身边,它与我们的生活息息相关.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
实 验 内 容 |  |  |  |
| 实 验 现 象 | B(填字母编号) 瓶口的蓝色石蕊试纸很快变 红. | 两试管中均产生 气体 | 试管E:绿色粉末逐渐溶解,产生气泡,溶液显蓝色. 试管F:绿色粉末逐渐溶解,产生气泡,溶液显绿色. |
| 分 析 与 结 论 | 该酸有挥发性,另一种酸没有.不同的酸可能有不同的物理性质 | 不同的酸具有相似的化学性质,这是因为酸溶液中都含有H+(填符号). | 试管E中发生反应的化学方程式:Cu2(OH)2CO3+2H2SO4═ 2CuSO4+3H2O+CO2↑ 试管F中发生反应的化学方程式:Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
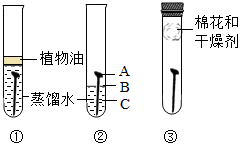 某学习小组用相同的光亮铁钉探究铁生锈与哪些因素有关,设计的实验如图所示:
某学习小组用相同的光亮铁钉探究铁生锈与哪些因素有关,设计的实验如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
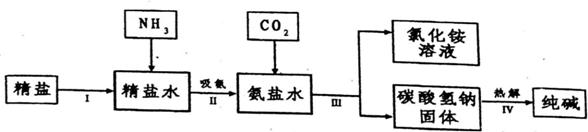
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com