
| 组合 | 胶头滴管中的试剂 | 集气瓶中的试剂 |
| A. | 稀硫酸 | Na2CO3 |
| B. | 稀盐酸 | Zn |
| C. | 浓硫酸 | 水 |
| D. | NaOH溶液 | CO2 |
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:初中化学 来源: 题型:阅读理解

| 验实号编 | 试剂 | 前 10min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:
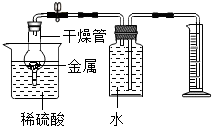 (2013?贵阳模拟)某班级兴趣小组计划对金属与酸反应的情况进实验探究.
(2013?贵阳模拟)某班级兴趣小组计划对金属与酸反应的情况进实验探究.| 实验编号 | 锌的质量 | 足量稀硫酸的浓度 | 时间 | 生成氢气的体积 |
| 实验一 | 1.3g | 5% | 169分钟 | 448mL |
| 实验二 | 1.3g | 10% | 66分钟 | 448mL |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
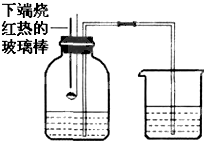 人类的生存离不开氧气.某校化学兴趣小组的同学在老师的指导下做了有关氧气的系列探究实验:
人类的生存离不开氧气.某校化学兴趣小组的同学在老师的指导下做了有关氧气的系列探究实验:| 实验序号 | H2O2溶液 浓度% |
H2O2溶液 体积/mL |
温度/℃ | MnO2的 用量/g |
收集氧气的 体积/mL |
反应所需 的时间/s |
| ① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
| ② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| ③ | 30 | 5 | 35 | 0 | 2 | 49.21 |
| ④ | 30 | 5 | 55 | 0 | 2 | 10.76 |
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| △ |
| ||
| △ |
| ||
| ||
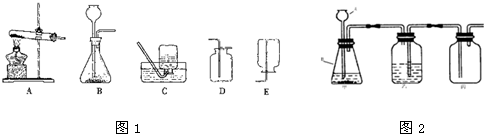
| 制取的气体 | 甲中盛放的试剂 | 乙中盛放的试剂 | 评价(回答是否可行,若不可行说明理由) |
| H2 | 锌粒和稀硫酸 | 浓H2SO4 | 不可行,因为氢气的密度比空气小,应用向下排空气法收集 不可行,因为氢气的密度比空气小,应用向下排空气法收集 |
| CO2 | 大理石和稀盐酸 | 浓NaOH溶液 | 不可行,因为二氧化碳与氢氧化钠溶液可反应,收集不到气体 不可行,因为二氧化碳与氢氧化钠溶液可反应,收集不到气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 验实号编 | 试 剂 | 前 10min 内产生的氢气体积(mL) | |
| 不同纯度的锌 | 不同体积和浓度的稀硫酸 | ||
| a | 纯锌 | 30mL 30% | 564.3 |
| b | 含杂质的锌 | 30mL 30% | 634.7 |
| c | 纯锌 | 30mL 20% | 449.3 |
| d | 纯锌 | 40mL 30% | 602.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com