
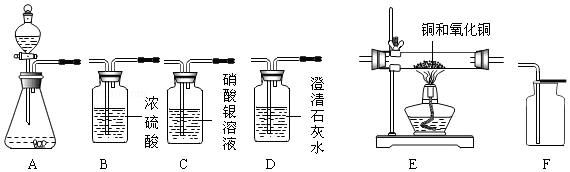
分析 (1)①根据实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,二氧化碳,密度比空气大,浓硫酸有吸水性进行分析;
②根据碳酸钙和盐酸反应生成氯化钙、水和二氧化碳进行分析;
③根据二氧化碳不具有助燃性进行分析;
(2)①根据氢气和氧化铜在加热的条件下生成铜和水进行分析;
②根据氧化铜和氢气反应的水被B2吸收,依据B2增加的质量计算参加反应的氧化铜的质量和生成铜的质量,依据铜和硝酸银反应生成硝酸铜和银,依据固体减少的质量计算参加反应的铜的质量进行计算;
③根据完全反应后B2装置的质量变化测定样品中铜单质的质量分数,若装置中不连接B1,则样品中铜单质的质量分数将偏小,因为水多了,氧化铜就多了,计算出的铜与氧化铜的质量比就偏小了进行分析;
④根据硫酸和锌反应后,硫酸的质量偏小了,溶液的pH值就偏大了进行分析.
解答 解:(1)①碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,制取并收集干燥、纯净的二氧化碳气体,要先除杂质再干燥,因此正确的顺序是:ACBF;
②碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
③二氧化碳不具有助燃性,所以验满的方法是:把燃着的木条放在集气瓶口,木条熄灭,证明集满;
(2)①氢气和氧化铜在加热的条件下生成铜和水,所以E处大玻璃管内可以观察到的现象是:黑色固体变为红色;
②设生成铜的质量为x,参加反应的氧化铜的质量为y
CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O
80 64 18
y x 0.9g
$\frac{80}{y}$=$\frac{64}{x}$=$\frac{18}{0.9g}$
x=3.2g
y=4g
与硝酸银反应的铜的质量为z
2AgNO3+Cu=Cu(NO3)2+2Ag 固体增加的质量
64 216 152
z 15.2g
$\frac{64}{z}$=$\frac{152}{15.2g}$
z=6.4g
所以样品中含有铜的质量为3.2g,原混合物样品中铜与氧化铜的质量比为:3.2g:4g=4:5;
③完全反应后B2装置的质量变化测定样品中铜单质的质量分数,若装置中不连接B1,因为水多了,氧化铜就多了,计算出的铜与氧化铜的质量比就偏小了;
④硫酸和锌反应后,硫酸的质量偏小了,溶液的pH值就偏大了.
故答案为:(1)ACBF;
②CaCO3+2HCl═CaCl2+H2O+CO2↑;
③把燃着的木条放在集气瓶口,木条熄灭,证明集满;
(2)①黑色固体变为红色;
②4:5;
③偏小;
④稀硫酸与锌粒反应被消耗,使溶液的酸性变弱,pH变大.
点评 本题主要考查常见气体的发生装置与收集装置的探究,发生装置依据反应物的状态和反应条件选择,收集装置依据气体的密度和溶解性选择.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
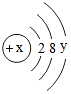 如图是某粒子的结构示意图,回答下列问题:
如图是某粒子的结构示意图,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com