
| 实验方法 | 现象 | 结论 |
| 与BaCl2、盐酸混合液作用 | 有白色沉淀产生 | A溶液有________离子 |
| 与Zn粒作用,将产生的气体点燃 | 火焰呈淡蓝色 | A溶液有________离子 |
| 与紫色石蕊试液作用 | 紫色石蕊试液变为________色 | A溶液显酸性 |


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:初中化学 来源: 题型:
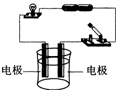
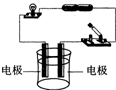
 甲、乙、丙三位同学在电解蒸馏水时,发现在电极上产生的气泡很少,但加入适量稀硫酸后产生气泡的速度明显加快.
甲、乙、丙三位同学在电解蒸馏水时,发现在电极上产生的气泡很少,但加入适量稀硫酸后产生气泡的速度明显加快.| 实验序号 | 实验方法 | 现 象 | 结 论 |
| Ⅰ | 与BaCl2、盐酸 混合液作用 |
有白色沉淀产生 有白色沉淀产生 |
A溶液含SO42-离子 |
| Ⅱ | 与Zn粒作用,将 产生的气体点燃 |
火焰呈淡蓝色 | A溶液有 H+ H+ 离子 |
| Ⅲ | 与紫色石蕊试液作用 | 紫色石蕊试 液显 红 红 色 |
A溶液显酸性 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验方法 | 现象 | 结论 |
| 与BaCl2、盐酸混合液作用 | 有白色沉淀产生 | A溶液有 SO42- SO42- 离子 |
| 与Zn粒作用,将产生的气体点燃 | 火焰呈淡蓝色 | A溶液有 H+ H+ 离子 |
| 与紫色石蕊试液作用 | 紫色石蕊试液变为 红 红 色 |
A溶液显酸性 |
查看答案和解析>>
科目:初中化学 来源: 题型:

| ||
| ||

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com