
【题目】有一包金属粉末,可能由Mg、Al、Zn、Fe中的一种或几种组成。向2.4g该金属粉末中加入100g稀硫酸,充分反应,生成0.2g H2,金属无剩余。下列说法正确的是
A. 金属粉末中一定含有MgB. 金属粉末中一定含有Al
C. 金属粉末中可能含有四种金属D. 稀硫酸的质量分数为9.8%
【答案】C
【解析】
A、样品中等质量的金属与稀硫酸反应生成的氢气铝比镁多,等质量的铁、锌比镁生成的氢气少,故可能是铁与铝或是锌与铝的混合物,不符合题意;
B、2.4gMg完全反应产生的氢气质量恰好是0.2g,故可能是纯净物镁,不符合题意;
C、样品中等质量的金属,Mg与稀硫酸反应产生的氢气为0.2g,Al与稀硫酸反应产生的氢气大于0.2g,Zn、Fe与稀硫酸反应产生的氢气小于0.2g,根据平均值法,金属粉末中可能含有四种金属,故符合题意;
D、当稀硫酸恰好完全反应时,生成氢气的质量为0.2g,含0.2g的氢元素的硫酸的质量为0.2g![]() =9.8g,故硫酸的质量分数为
=9.8g,故硫酸的质量分数为![]() ⅹ100%=9.8%,但题中未说明稀硫酸是否完全反应,故不符合题意
ⅹ100%=9.8%,但题中未说明稀硫酸是否完全反应,故不符合题意


科目:初中化学 来源: 题型:
【题目】学习化学后,我们学会了从微观角度认识事物,根据下列几种微粒示意图,回答问题:
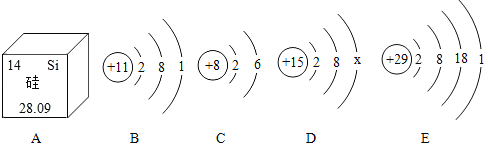
(1)由图A可知Si元素的相对原子质量为___。
(2)B图微粒易___(填“失去”或“得到”)电子后就变成阳离子。
(3)若D是离子结构示意图,则x=___。
(4)元素E处于第___周期。
(5)由B、C两种元素组成的化合物的化学式为___,该化合物___氧化物(填“属于”或“不属于”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有如下转化关系:①Zn![]() ZnSO4,②ZnO
ZnSO4,②ZnO![]() ZnSO4,③Zn(OH)2
ZnSO4,③Zn(OH)2![]() ZnSO4。对这三种转化关系比较归纳正确的是( )
ZnSO4。对这三种转化关系比较归纳正确的是( )
A. 三种转化都只能通过与稀硫酸反应来实现B. 实验室制取硫酸锌的方法只有这三种
C. 上述四种物质中锌元素的化合价均为+2价D. 金属单质、金属氧化物、碱可以转化为盐
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,广口瓶中盛有气体X,胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入广口瓶中,振荡,一段时间后可见小气球a膨胀鼓起。下表中的各组物质不会出现上述现象的是( )
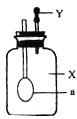
X | Y | |
A | CO | Ca(OH)2溶液 |
B | CO2 | NaOH溶液 |
C | HCl | Ca(OH)2溶液 |
D | SO2 | NaOH溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是( )

A. 甲是易溶物质,乙是可溶物质
B. t℃时,甲、乙两种物质的溶解度相同
C. 升高温度能使接近饱和的甲的溶液变为饱和溶液
D. 若甲的溶液中混有少量的乙,可用蒸发溶剂的方法提纯甲
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组在实验室里进行木炭还原氧化铜的实验。
(实验1)装置如图。
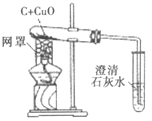
(1)木炭还原氧化铜的化学方程式为__,当碳与氧化铜的质量比为__(写最简整数比)时恰好完全反应。
(2)下列有关本实验的说法正确的是____(填字母)。
A 酒精灯加网罩以使火焰集中并提高温度
B 氧化铜发生了还原反应,木炭发生了氧化反应
C 观察到石灰水变浑浊即可证明氧化铜被还原了
D 反应后先撤出导气管,待试管冷却后再把其中的粉末倒出
(提出问题)实验1中,加热5分钟后仅能得到混有少量红色固体的黑色粉末。如何让木炭还原氧化铜时得到更多的铜呢?
(实验2)该小组同学在老师的指导下改进了实验,装置如图,加热2分钟后即得到紫红色有金属光泽的块状固体,且无黑色固体剩余。
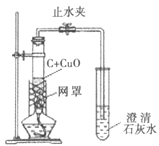
(1)刚烘干的木炭粉末与氧化铜粉末要在同一个研钵内充分研磨、混合均匀后再放入试管,这样做能使反应更充分,其主要原因是__。
(2)本实验所用的木炭与氧化铜的质量比为1︰10,碳需要略过量才能使氧化铜全部被还原,其主要原因是____。
(3)反应物放入试管后要尽量压实,并将试管竖直进行加热,使其下部完全被外焰包围,受热均匀,获得持续的高温。
(4)反应后关闭止水夹,让产物自然冷却,这时试管里残余的________就成了保护气。
(5)加了网罩的酒精灯火焰最高温度能达到800℃,而铜的熔点是1083℃。本实验获得了经熔化而成珠状或小块状的铜,可以推测木炭还原氧化铜的反应是________热量的。
(查阅资料)木炭还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4=CuSO4+Cu+H2O。
(拓展探究)将实验2得到的紫红色有金属光泽的块状固体全部研磨成粉末。
(1)将全部粉末放入烧杯中,加入足量稀硫酸,充分反应后,观察到______,证明实验2得到的铜中含有氧化亚铜;再经过滤、洗涤、干燥,得到纯净的单质铜1.52g。
(2)已知实验2使用的氧化铜粉末的质量为2.00g,不考虑实验过程中的损耗,则实验2得到的紫红色有金属光泽的块状固体中,单质铜的质量分数为______(计算结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究性学习小组以“酸与碱能否发生反应”为课题进行了实验探究。
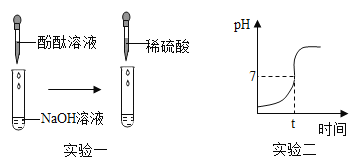
(实验一)
(1)向滴有酚酞试液的NaOH溶液中滴入稀硫酸,观察到溶液颜色由_____,证明硫酸和氢氧化钠发生了反应,该反应的化学方程式为_____。
(2)继续往上述反应后的溶液中逐滴滴入NaOH溶液,不断振荡,如果观察到_____现象,证明了滴加的稀硫酸过量。
(实验二)测量酸和碱反应过程的pH
(1)实验过程中用传感器实时获得溶液的pH,要得到如图所得变化曲线,所进行的操作是_____(填字母)。
A 将稀硫酸溶液逐滴滴加到氢氧化钠溶液中
B 将氢氧化钠溶液逐滴滴加到稀硫酸溶液中
(2)根据如图2溶液pH变化,判断酸和碱发生反应的依据是_____。
(实验三)小组同学经过讨论,一致认为除了上述方法外,还可以按照如表实验方法证明硫酸和氢氧化钠发生了反应。
实验步骤 | 实验现象 | 实验结论 |
取少量氢氧化钠溶液于试管中,加入过量的稀硫酸,再加入少量的氧化铜 | 得到蓝色溶液,无_____ | 氢氧化钠和硫酸发生了化 学反应 |
(拓展延伸)同学们对氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分产生了浓厚的兴趣,于是进行了进一步的探究。
(提出问题)氢氧化钠溶液和稀硫酸反应后溶液中的溶质成分
(提出猜想)猜想一:Na2SO4猜想二:Na2SO4和H2SO4你的合理猜想是:_____。
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
取少量反应后的溶液置于试管中_____ | _____ | 猜想二正确 |
(实验反思)在分析化学反应后所得物质成分时,除考虑生成物外还需要考虑反应物是否有剩余。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铁是常见的金属元素,它在元素周期表中的信息如图所示,下列有关说法错误的是( )
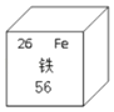
A. 铁原子的核外电子数为26,中子数为30
B. 该元素组成的单质是目前世界年产量最高的金属
C. 该元素是地壳中含量最高的金属元素
D. 该原子的相对原子质量为56
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是学习和研究化学的重要工具,它的内容十分丰富.如图是元素周期表的部分内容,请回答下列问题:
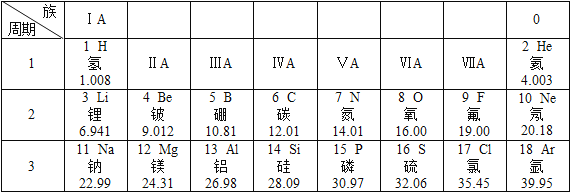
(1)请从如图中查出地壳中含量最多的金属元素的符号___和相对原子质量___.
(2)写出第二周期中的金属元素的名称___、___.
(3)不同元素的本质区别是___.
(4)分析如图,可以看出同一周期的规律是___.
(5)8号元素和13号元素形成化合物的名称为___.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com