


分析 【探究活动一】
铁与水和氧气同时接触时容易生锈,因此隔绝水和氧气可以防止铁制品生锈;
铁在氧气中燃烧生成四氧化三铁;
【探究活动二】
铁和稀硫酸反应生成硫酸亚铁和氢气;
对比试验要确定好常量和变量;
镁比铁活泼,铁比铜活泼;
【探究活动三】
高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳;
一氧化碳有毒,具有可燃性,和空气或氧气混合达到一定程度时,遇明火会发生爆炸;
氢氧化钠溶液能够吸收二氧化碳气体;
铁比铜活泼,铜比银活泼.
解答 解:【探究活动一】
(1)用后擦干涂油可以防止铁锅生锈.
故填:涂油.
(2)铁丝在纯氧中燃烧的化学方程式为:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
故填:3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4.
【探究活动二】
(3)试管B中铁和稀硫酸反应生成硫酸亚铁和氢气,反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑.
故填:Fe+H2SO4=FeSO4+H2↑.
(4)张昕同学认为该实验能得出这三种金属的活动性由强到弱依次为镁、铁、铜,晓梅同学认为该实验设计不合理,她的理由是没有控制变量,即利用的酸分别是稀盐酸和稀硫酸.
故填:没有控制变量.
(5)①将镁片、铁片分别浸入到硫酸铜溶液中时,镁片、铁片表面都附着一层红色固体,说明镁、铁都比铜活泼,不能比较镁和铁的活泼性,该选项不可行;
②将镁片、铜片分别浸入到硫酸亚铁溶液中时,镁片表面附着一层红色固体,说明镁比铁活泼,铜片无明显现象,说明铁比铜活泼,该选项可行;
③铁片浸入到硫酸镁溶液中时,无明显现象,说明镁比铁活泼,铁片浸入到硫酸铜溶液中时,铁片表面附着一层红色固体,说明铁比铜活泼,该选项可行;
④将铜片分别浸入到硫酸亚铁、硫酸镁溶液中时,都无明显现象,说明说明镁、铁都比铜活泼,不能比较镁和铁的活泼性,该选项不可行.
故填:②③.
【探究活动三】
(6)A装置中氧化铁和一氧化碳反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(7)氧化铁中氧元素质量为:10.0g-7.6g=2.4g,
氧化铁质量为:2.4g÷($\frac{48}{160}$×100%)=8g,
赤铁矿中含氧化铁的质量分数为:$\frac{8g}{10.0g}$×100%=80%,
故填:80%.
(8)①实验开始时,如果先加热,再通入一氧化碳,可能会发生爆炸,该选项说法不正确;
②整套装置有一个明显的不足之处是没有进行尾气处理,该选项说法正确;
③反应结束后,如果立即停止通入一氧化碳,会导致铁被空气中的氧气氧化,该选项说法不正确;
④B装置质量的增加量是反应生成二氧化碳的质量,根据二氧化碳质量和反应的化学方程式可以计算氧化铁质量,进一步可以计算杂质质量,从而计算出含杂质的质量分数,该选项说法正确.
故填:②④.
【探究活动四】
(9)A、加入铁粉时,铁先和硝酸银反应,后和硝酸铜反应,因此加入铁粉一定质量后才开始生成铜,该选项对应关系正确;
B、铁和硝酸银反应生成硝酸亚铁和银,随着反应进行,溶液质量减小,铁和硝酸铜反应生成硝酸亚铁和铜,随着反应进行,溶液质量减小,当硝酸银、硝酸铜完全反应后溶液质量不再变化,该选项对应关系正确;
C、铁和硝酸银反应生成硝酸亚铁和银,当硝酸银完全反应后,硝酸银质量分数为零,该选项对应关系不正确;
D、铁和硝酸银反应过程中,溶液中的金属阳离子由银离子、铜离子和反应生成的亚铁离子,硝酸银完全反应后,溶液中的金属阳离子有亚铁离子和铜离子,硝酸铜完全反应后,溶液中的金属阳离子是亚铁离子,该选项对应关系正确.
故填:C.
点评 本题考查了物质的检验与鉴别方法、铁及其氧化物的性质等知识,题目难度较大,注意掌握常见金属单质及其化合物性质,明确物质检验与鉴别的实验方案的设计方法.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 可以使紫色石蕊试液变红 | B. | 可以与锌反应生成氢气 | ||
| C. | 浓盐酸易挥发 | D. | 可以与氧化铜反应生成氯化铜和水 |
查看答案和解析>>
科目:初中化学 来源:【全国区级联考】江苏省盐城市亭湖区2017届九年级毕业班下学期第二次质量检测化学试卷 题型:信息分析题
⑴化学用语是学习化学的重要工具,用适当的化学符号填空
①2个氩原子______; ②人体内含量最高的金属元素________;
③醋酸溶液中的阳离子是______; ④极易与血红蛋白结合的有毒气体是______。
⑵化学——我们的生活 ,利用你所学的化学知识,完成下列相关问题:
①梅花扑鼻香自来,从分子性质的角度解释,这是因为__________。
②将乒乓球碎片和滤纸片置于薄铜片上,用酒精灯火焰加热铜片。能验证燃烧的条件之一是:
__________________。
③洗涤剂去除油污是因为洗涤剂具有____作用。
④打开汽水瓶塞,有气泡冒出,说明气体溶解度与____有关。
⑤英语中有句谚语“每天一个苹果,医生远离我”,说明苹果是一种对人体健康非常有益的水果,苹果为人体提供的对应营养素是_________ 。
⑥装汽水的塑料瓶属于______(填“金属材料”或“合成材料”或“复合材料”)。
查看答案和解析>>
科目:初中化学 来源:【全国区级联考】江苏省盐城市亭湖区2017届九年级毕业班下学期第二次质量检测化学试卷 题型:选择题
在配制一定溶质质量分数的蔗糖溶液时,导致溶液中蔗糖的质量分数偏大的可能原因有( )
A.用量筒量取水时俯视读数
B.用来配制溶液的烧杯刚用少量蒸馏水润洗过
C.用托盘天平称取蔗糖时,将蔗糖放在右盘,且称量时使用了游码
D.用了含少量杂质的蔗糖配制溶液
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
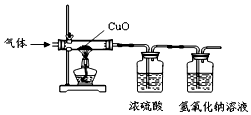 某气体由氢气、一氧化碳、水蒸气中的一种或几种组成.把该气体依次通过下列装置后,测得装有浓硫酸的装置质量增加,装有氢氧化钠溶液的装置质量不变.
某气体由氢气、一氧化碳、水蒸气中的一种或几种组成.把该气体依次通过下列装置后,测得装有浓硫酸的装置质量增加,装有氢氧化钠溶液的装置质量不变.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
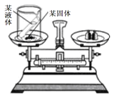 某科学兴趣小组的同学利用如图所示实验装置验证质量守恒定律. 则小试管中的液体和烧杯中的固体应分别选用( )
某科学兴趣小组的同学利用如图所示实验装置验证质量守恒定律. 则小试管中的液体和烧杯中的固体应分别选用( )| A. | 水和氯化钠固体 | B. | 氢氧化钙溶液和碳酸钠粉末 | ||
| C. | 稀盐酸和铁粉 | D. | 5%双氧水和二氧化锰粉末 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com