
以下是某研究小组探究影响反应速率部分因素的相关实验数据.
| 实验序号 | 过氧化氢溶液浓度、% | 过氧化氢溶液体积/ml | 温度/C | 二氧化锰的用量/g | 收集氧气的体积/ml | 反应所需的时间/s |
| 1 | 5 | 1 | 20 | 0.1 | 4 | 16.74 |
| 2 | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
| 3 | 30 | 5 | 35 | | 2 | 49.21 |
| 4 | 30 | 5 | 55 | | 2 | 10.76 |
 智能训练练测考系列答案
智能训练练测考系列答案科目:初中化学 来源: 题型:探究题
某化学小组测定空气中氧气的体积分数。
(1)根据右图回答问题。
①红磷燃烧的化学方程式为 。
②若将红磷改为木炭,反应结束后降至室温,打开止水夹,烧杯中的水不倒吸入集气瓶的原因是 _。
(2)用四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数。
反应原理为:2Na2S4+O2+2H2O=8S↓+4NaOH(氢氧化钠)。
小资料:四硫化钠(Na2S4)与氧气、水反应生成难溶于水的固体硫(S)和易溶于水
的氢氧化钠。
【实验过程】
①取足量的四硫化钠固体加入试管中,再加入适量的水,迅速塞紧橡胶塞,充分振荡。测量液面至橡胶塞下沿的距离,记录数据h1(如图1所示)。
图1 图2
②将该试管插入水中(如图2所示),拔下橡胶塞,观察到 ,塞紧橡胶塞。将试管取出,倒转过来,测量液面至橡胶塞下沿的距离,记录数据h2。理论上h2∶h1= 。
③按照①和②再重复实验2次。3次实验数据如下表所示。
| | 第1次 | 第2次 | 第3次 |
| h1/cm | 11.0 | 11.4 | 11.6 |
| h2/cm | 8.7 | 9.1 | 9.2 |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某兴趣小组在学习碱的化学性质时,进行了如下所示的实验.
(1)实验①中盐酸和氢氧化钠反应的化学方程式为 .
(2)实验②中观察到试管内有白色沉淀产生,反应的化学方程式为 .
(3)实验③中滴加氢氧化钠溶液后,可观察到的现象是 .
实验结论:碱能与多种类别的物质发生反应,包括指示剂、非金属氧化物、酸和盐类等.
【反思交流】实验结束后,同学们对实验②的废液成分进行了探究:将实验②的废液进行过滤,滤渣所含的成分是 .
【提出问题】滤液中所含溶质是什么物质呢?
【做出猜想】猜想一:滤液中的溶质是氢氧化钠.
猜想二:滤液中的溶质是氢氧化钠和碳酸钠.
猜想三:滤液中的溶质是氢氧化钠和 .
【实验设计】同学们取滤液样品并加入酚酞溶液,溶液呈红色,继续逐滴加入稀盐酸,发现溶液逐渐变无色,同时有气泡产生.由此得出结论,猜想 正确.
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
某同学为测定12g含杂质的氧化铁样品中氧化铁的质量分数,利用稀硫酸和锌粒制取氢气,设计了下图所示的装置,进行有关的实验探究(提示:3H2+Fe2O3 2Fe+3H2O杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:
2Fe+3H2O杂质不参加反应,假定每步均完全反应或吸收).请回答有关问题:
得到如下数据:
| 装置 | B | C |
| 反应前质量 | 86.3g | 284.2g |
| 反应后质量 | 83.9g | 286.9g |
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
同学们在学习酸和碱的化学性质时,进行了如图所示的实验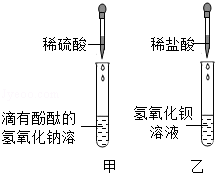
(1)甲实验中能证明两种物质发生反应的明显现象是
(2)实验结束后,同学们将甲、乙两个实验所得的无色废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:硫酸钡、指示剂、水、碱类物质和 (写化学式或名称)
②对碱类物质是什么?同学们有如下猜想
猜想一:只有氢氧化钠
猜想二:只有氢氧化钡
猜想三:是氢氧化钠和氢氧化钡
你认为猜想 是错误的
【实验设计】若要证明剩余的两种猜想,可选用的试剂是
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
水滑石化学式为:[Mg6Al2(OH)16CO3]?4H2O(相对分子质量为602),是环保型阻燃剂,它受热时生成4种不同的氧化物,请写出该物质分解的化学方程式: 。在医药上,水滑石还能作为抗酸药,作用于胃和十二指肠溃疡等,某研究型学习小组要测定一种市售的水滑石药片中水滑石的质量分数。
[查阅资料]水滑石与稀硫酸反应的化学方程式为:[Mg6Al2(OH)16CO3]?4H2O+9H2SO4=6MgSO4+Al2(SO4)3+CO2↑+21H2O,药片中除了水滑石外含有一定量的辅料﹣﹣淀粉等物质。
[提出猜想]小华想将该药片放在空气中充分灼烧完成测定;小明想通过水滑石与硫酸反应原理来完成测定,请你参与探究。
[设计方案]他们设计了不同的实验方案。
小华的方案,称取10.0g市售的水滑石药片研磨成粉末置于通风橱中,充分灼烧至质量不再减少,再称量剩余固体的质量为6.1g,减少的质量即为二氧化碳和水的总质量,则可求的水滑石药片中水滑石的质量分数为 %。
小明的方案:
(1)小明设计了如图所示的实验装置.取10.0g市售的水滑石药片研磨成粉末,进行实验。
[说明]碱石灰是氧化钙和氢氧化钠固体的混合物,B装置中发生的化学方程式为 。
(2)操作步骤
①连接好装置,检查装置的气密性②打开弹簧夹C,在A处缓缓通入一段时间的空气③称量F的质量④关闭弹簧夹C,慢慢滴加稀硫酸至过量,直至D中无气泡冒出⑤打开弹簧夹C,再次缓缓通入一段时间空气⑥再次称量F的质量,得前后两次质量差为0.44g。
(3)问题探究
B、E装置的作用分别是 、 。若没有G装置,则测定的水滑石的质量分数会 (填“偏大”、“偏小”、“不变”)。实验选用稀硫酸而不选用稀盐酸的理由是 。
(4)数据计算
根据实验数据,可求得水滑石药片中水滑石的质量分数为 %.(写出计算过程)。
[方案评价]在上述实验方案中,你认为合理的实验方案是 (填小华或小明),另一个方案不合理的原因是 。
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
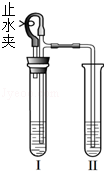
用如图所示装置分别进行两个实验(已知:氯化钙溶液呈中性).
(1)打开止水夹,向Ⅰ中液体加入一种黑色固体、Ⅱ中液体加入一种白色固体.Ⅰ和Ⅱ中均有气泡出现,且Ⅱ中液体内出现燃烧现象.
①写出燃烧反应的化学方程式 .
②请说明Ⅱ中出现燃烧的原因 .
(2)打开止水夹,向Ⅰ中液体加入一小块固体.Ⅰ和Ⅱ中均有气泡出现,且Ⅱ中液体出现浑浊现象.关闭止水夹,发现Ⅱ中液面上升,溶液由浑浊变澄清.
①请说明溶液由浑浊变澄清的原因 .
②若实验后Ⅱ中澄清液中的溶质由一种或两种物质组成,为检验其成分,应该进行的实验操作是
.
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
小明同学在一本化学资料中发现KClO3晶体在MnO2的催化下,能分解生成O2和氯化钾,于是提出疑问,CuO能催化KClO3的受热分解反应吗?于是设计了以下实验:
[实验方案] ①任取2份氯酸钾,分别放于两支试管中,仅向其中一支试管中加入m克CuO; ②将上述盛有KClO3的两支试管,在相同条件下同时加热,并使产生的气体通入水中,观察产生气泡的速率 , 比较产生气体的速率;③充分反应后冷却,将放入CuO的试管内固体残余物加水溶解,滤出不溶物,洗涤并干燥; ④观察滤出固体物质的颜色状态为黑色固体。 ⑤将滤出固体与碳粉混合后,在密闭容器中加热,将所产生的气体通过澄清石灰水,观察现象黑色固体变为红色,石灰水变浑浊 。
[交流讨论] (1)步骤:①②的目的是通过对比实验,探究
在第三步过滤操作中用到的玻璃仪器为 、 、
(3)步骤⑤的目的是证明
(4)小红认为小明实验中有缺陷,请你帮小红改进实验中的不足之处: 、
查看答案和解析>>
科目:初中化学 来源: 题型:探究题
为了解环境因素对维生素C含量的影响,从而更好地保存有关食物,某兴趣小组同学根据维生素C可使高锰酸钾(KMn04;)溶液褪色的原理,进行了如下表所示的实验。
| 编号 | 维生素C溶液的处理方法 | 使40毫升KMn04溶液褪色的平均滴数 |
| 1 | 放置于室内暗处0.5小时 | 15 |
| 2 | 强烈阳光直射5小时后,放置于室内暗处0.5小时 | 22 |
| 3 | 煮沸l0分钟后,放置于室内暗处0.5小时 | 21 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com