
| A. | 滤渣中一定有镁粉 | B. | 滤渣中一定有铜和银 | ||
| C. | 滤液中一定有Mg2+ | D. | 滤液中一定有Ag+和Cu2+ |
分析 在金属活动性顺序中,Mg>H>Cu>Ag,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,据此分析判断有关的问题.
解答 解:在金属活动性顺序中,Mg>H>Cu>Ag,往AgNO3和Cu(NO3)2的混合溶液中加入一定量的镁粉.镁先与硝酸银反应,当硝酸银反应完全后,镁再与硝酸铜反应;充分反应后过滤,向滤渣中加入稀盐酸,有气泡产生,说明了镁有剩余.所以:
A、由上述分析可知,滤渣中一定有镁粉,故A正确;
B、由于镁有剩余,能将溶液中银铜全部置换出来,所以滤渣中一定有铜和银,故B正确;
C、由于镁与硝酸银、硝酸铜发生了反应,滤液中一定有Mg2+,故C正确;
D、由于镁有剩余,能将溶液中银铜全部置换出来,所以滤液中一定不含有Ag+和Cu2+.故D错误.
故选D.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序的意义进行.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁 | 试管外壁发热 | 原因是:氢氧化钠固体.溶于水放热 |
| ②向①所得的溶液中逐滴加入稀硝酸至过量 | 开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体 | 样品中含有的杂质是Na2CO3. |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀现象 | 样品中还含有的杂质是NaCl. |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 蒸发滤液时,待蒸发皿中滤液蒸干后停止加热 | |
| B. | 粗盐溶解和过滤操作时,都用到了玻璃棒,玻璃棒的作用相同 | |
| C. | 配制该溶液需要氯化钠8g,水42g | |
| D. | 配制溶液需要经过计算、称量、量取、溶解、装瓶、贴标签等步骤 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 选项 | A | B | C | D |
| 实验目的 | 除去CO2中的CO | 证明醋酸呈酸性 | 鉴别硫酸钾和硝酸铵固体 | 除去CaCl2溶液中的盐酸 |
| 选用试剂或方法 | 点燃 | 加无色酚酞 | 加热石灰研磨 | 加碳酸钙足量(其他合理答案均可) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
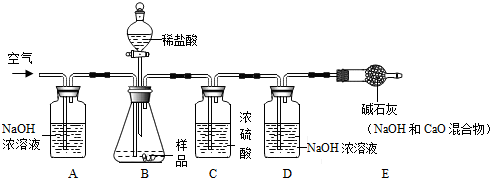
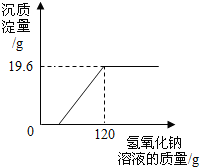 某环保小组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保小组的同学进行了以下实验.取废水500g,向其中加入溶质质量分数为20%的氢氧化钠溶液.测得沉淀质量与所加入的氢氧化钠溶液的质量关系如图.根据图中所得数据计算:
某环保小组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保小组的同学进行了以下实验.取废水500g,向其中加入溶质质量分数为20%的氢氧化钠溶液.测得沉淀质量与所加入的氢氧化钠溶液的质量关系如图.根据图中所得数据计算:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
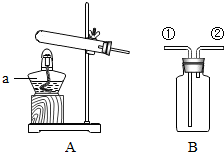 小何同学欲用氯酸钾来制取氧气,并回收提纯氯化钾和二氧化锰.
小何同学欲用氯酸钾来制取氧气,并回收提纯氯化钾和二氧化锰.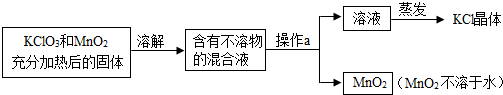
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
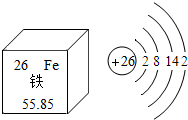 化学是一门研究物质的科学,我们一般从物质的存在、性质、制备、用途等方面研究一种物质或一类物质.以金属铁为例.请你参与其中回答相关问题:
化学是一门研究物质的科学,我们一般从物质的存在、性质、制备、用途等方面研究一种物质或一类物质.以金属铁为例.请你参与其中回答相关问题: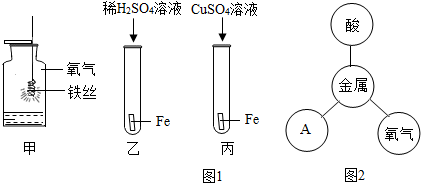
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 石油是工业的血液,应保护好南海石油资源 | |
| B. | 稀土是不可再生的重要战略资源,应合理利用和保护 | |
| C. | 合金的熔点一般比纯金属高 | |
| D. | 地球上水储量是丰富的,但可利用的淡水资源是有限的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com