
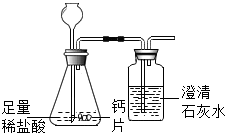
 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25g | 100g | 200g | 300.4g |
| 加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
| 充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
分析 通过资料:补钙剂中的糖类、维生素D等,这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解,根据碳酸钙与稀盐酸反应生成二氧化碳的质量来测定钙片中碳酸钙的含量.
解答 解:方案设计和实施
(1)根据题中信息,补钙剂中除碳酸钙外其他物质不与稀盐酸反应,锥形瓶中发生碳酸钙与稀盐酸反应,化学方程式为
CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)为防止二氧化碳气体溢出,长颈漏斗下部应插入液面下;
(3)加入药品前应检查装置的气密性,夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好;
分析和评价
(1)因为氢氧化钙微溶,澄清石灰水中的Ca(OH)2含量很少,吸收的二氧化碳量很少,所以方案2合理;
(2)根据资料补钙剂中糖类、维生素D等效,高温灼烧时会燃烧或分解,导致最终数据偏大,不能使用碳酸钙高温灼烧分解的方法.
(3)要使用查阅资料(3)中介绍的方法,还需要学习的是如何测未知浓度(剩余)盐酸的量,才能计算消耗盐酸的量最终求得碳酸钙的含量;
(4)根据生成气体的量计算钙片中碳酸钙的含量,
有实验记录可知:加入300g盐酸时碳酸钙已完全反应,生成二氧化碳的质量为,(300g+100g+25g)-418.4g=6.6g
设x碳酸钙与盐酸完全反应生成6.6g二氧化碳.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 6.6g
$\frac{100}{x}=\frac{44}{6.6g}$
x=15g
钙片中碳酸钙的质量分数为$\frac{15g}{25g}$×100%=60%.
故答案为:
方案设计及实施
(1)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(2)防止CO2气体逸出(液封);
(3)夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好;
分析和评价
(1)方案2;澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少;
(2)加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大;
(3)如何测定未知浓度(剩余)盐酸的量;60%.
点评 主要考查了碳酸钙的化学性质,通过实验培养学生的分析实验的能力和对知识的应用能力.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③⑤⑥ | C. | ①②③④⑤ | D. | ①②③⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 宜春实验中学化学兴趣小组为了解“水的净化”过程,从秀江河里取了水样,观察到水样呈淡黄色,有异味,也有固体小颗粒,现对水样进行如下处理:
宜春实验中学化学兴趣小组为了解“水的净化”过程,从秀江河里取了水样,观察到水样呈淡黄色,有异味,也有固体小颗粒,现对水样进行如下处理:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com