
分析 (1)根据铁的锈蚀实际是铁与空气中的水和氧气共同作用的结果进行解答;
(2)根据在金属活动性顺序中,Al>Zn>H>Cu>Ag,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来分析;
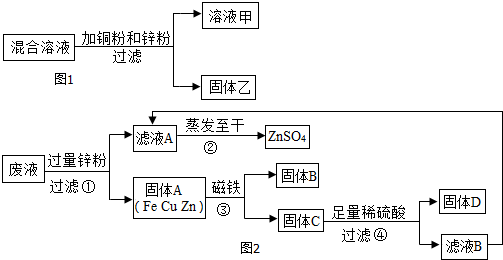
(3)Ⅰ加入过量的锌会把溶液中的铁与铜置换的更彻底一些.
Ⅱ步骤一中会发生两个金属与盐溶液的反应.
Ⅲ步骤④中的酸是否足量主要看固体D中是否含有未反应的锌.
(4)①根据黄铜的成分铜和锌的性质可知,加入稀硫酸时,只有锌与硫酸反应生成了硫酸锌和氢气,根据质量守恒定律可知,减少的质量就是生成的氢气的质量;
②根据锌与硫酸反应的方程式,由氢气的质量可以求出锌的质量,进而求出铜的质量和铜的质量分数.
解答 解:(1)铁的锈蚀实际是铁与空气中的水和氧气共同作用的结果;故填:水、氧气;
(2)在金属活动性顺序中,Al>Zn>H>Cu>Ag,锌与硝酸银反应生成硝酸锌和银,铜与硝酸银反应产生硝酸铜和银,而铝的活动性最强,所以不能发生反应,所以滤液中一定含有反应生成的硝酸锌和没有参加反应的硝酸铝;又因为溶液甲呈蓝色,说明滤液中还一定含有硝酸铜;
①因为有硝酸铜的存在,因此就不会有比铜活动性强的锌剩余,因此过滤、洗涤后往固体乙中加入稀盐酸,无气泡产生;
②溶液甲中含有没参加反应的硝酸铝,反应产生的硝酸锌,硝酸铜;
③该实验过程中所发生反应的化学方程式有:锌与硝酸银反应生成硝酸锌和银,铜与硝酸银反应生成硝酸铜和银,反应的方程式分别为:Zn+2AgNO3=Zn(NO3)2+2Ag;Cu+2AgNO3=Cu (NO3) 2+2Ag.
故答案为:①没有;
②Al( NO3) 3、Zn( NO3)2、Cu(NO3 ) 2;
③Zn+2AgNO3=Zn(NO3)2+2Ag;Cu+2AgNO3=Cu (NO3) 2+2Ag.
(3)Ⅰ因为只有加入过量的锌才会把溶液中的铁与铜置换的更彻底一些.
故答案为:将废液中的Cu2+和Fe2+全部置换出来
Ⅱ在此过程中发生了锌与硫酸铜和铁与硫酸铜的反应.
故答案为:Zn+CuSO4=ZnSO4+Cu(或Fe+CuSO4═Cu+FeSO4)
Ⅲ步骤④中的酸是否足量主要看固体D中是否含有未反应的锌,有则酸不足量,没有则酸足量.
故答案为:取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量(或若无气泡产生,则酸已足量).
(4)根据质量守恒定律可知,生成的氢气的质量为:98g+10g-107.9g=0.1g
(2)设样品中Zn的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.1g
$\frac{65}{x}=\frac{2}{0.1g}$
x=3.25g
铜的质量分数为$\frac{10g-3.25g}{10g}$×100%=67.5%
答:(1)反应生成氢气的质量为0.1g,(2)黄铜样品中铜的质量分数为67.5%.
点评 本题难度不大,掌握金属活动性顺序的应用,解题时只要抓住反应过程中金属与盐溶液的反应实质,并结合相关的实验过程就能顺利解题.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
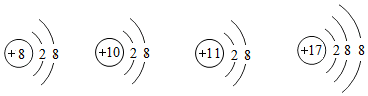
| A. | 它们都带电荷 | B. | 它们都具有相对稳定结构 | ||
| C. | 它们的核外电子排布不完全相同 | D. | 它们属于不同种元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 化学电池是一类重要的能源,废旧电池中的许多物质是可以回收利用的.某种型号的干电池的剖面图如图所示.现对其中的填充物(MnO2、C、可溶性填充物)进行探究,请填空:
化学电池是一类重要的能源,废旧电池中的许多物质是可以回收利用的.某种型号的干电池的剖面图如图所示.现对其中的填充物(MnO2、C、可溶性填充物)进行探究,请填空:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 烂菜叶、果皮 | B. | 废铜烂铁、旧衣服 | C. | 废电池、旧书报 | D. | 玻璃瓶、塑料袋 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 关注社会热点,承担社会责任.
关注社会热点,承担社会责任.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com