
| 实验编号 | 温度/℃ | pH | 测得p-CP的含量随时间变化的关系图 |
| a | 25 | 10 | 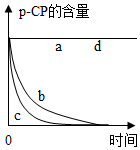 |
| b | 25 | 3 | |
| c | 40 | 3 | |
| d | 40 | 10 |
分析 (1)根据pH大于7溶液显碱性,欲使试样的pH小于7,应加入酸性物质解答;
(2)根据反应原理写出反应的化学方程式解答;
(3)根据通入氧气,测得p-CP含量没有变化解答;
(4)对比实验的基本思想是控制变量法,可以在温度相同时,变化浓度,或者在浓度相等时,变化温度;
(5)根据实验bc的数据来回答;
(6)根据实验数据内容进行分析;
(7)根据实验数据内容进行分析.
解答 解;
(1)pH大于7溶液显碱性,欲使试样的pH小于7,应加入酸性物质,NaOH溶液显碱性,稀HCl 呈酸性,NaCl溶液和水呈中性,故选b;
(2)步骤④有多个反应发生,其中产生氧气的化学方程式为:2H2O2═2H2O+O2↑.
(3)取样,加入MnO2和H2O2溶液,测得p-CP含量没有变化(或取样,通入氧气,测得p-CP含量没有变化),说明试样中p-CP含量的减少与产生氧气的反应无关;
(4)对比实验的基本思想是控制变量法,为探究pH对Fe2+、H2O2处理p-CP的反应快慢影响,可比较实验a和b或c或d.从两组实验对比中得到的结论是
pH越小,Fe2+、H2O2处理p-CP的反应速率越快;
(5)比较实验b和c,可以得到的结论是温度越高,Fe2+、H2O2处理p-CP的反应速率越快;
(6)实验a和d说明pH=10时,Fe2+、H2O2处理p-CP的反应不发生;
(7)根据实验数据内容可以看出,将所取样品迅速加入到一定量的NaOH溶液中,使pH为10,就可使样品中的降解反应立即停止下来.
答案:(化学方程式(3分),第(3)小题(2分),余每空1分)
(1)b;
(2)2H2O2═2H2O+O2↑;
(3)取样,加入MnO2和H2O2溶液,测得p-CP含量没有变化(或取样,通入氧气,测得p-CP含量没有变化);
(4)ab;cd;pH越小,Fe2+、H2O2处理p-CP的反应速率越快;
(5)温度越高,Fe2+、H2O2处理p-CP的反应速率越快;
(6)pH=10时,Fe2+、H2O2处理p-CP的反应不发生;
(7)往样品中加入氢氧化钠使溶液的pH等于10(或快速降温).
点评 本题考查学生化学平衡状态以及化学反应速率知识,要求学生具有分析和解决问题的能力,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 原子是最小的粒子,不可再分 | B. | 离子不能直接构成物质 | ||
| C. | “花香四溢”是因为分子在不断运动 | D. | 空气是由空气分子构成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧化汞受热分解 HgO2 $\frac{\underline{\;\;△\;\;}}{\;}$Hg+O2↑ | |
| B. | 红磷在氧气中燃烧 P+O2$\frac{\underline{\;点燃\;}}{\;}$P2O5 | |
| C. | 铁丝在氧气中燃烧 3Fe+2O2 $\frac{\underline{\;点燃\;}}{\;}$Fe3O4 | |
| D. | 电解水 2H2O═2H2↑+O2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 同学们正在化学实验室完成“实验活动6--酸、碱的化学性质”
同学们正在化学实验室完成“实验活动6--酸、碱的化学性质”查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com