
| 序号 | 实验1 | 实验2 | 实验3 |
| 方 案 | 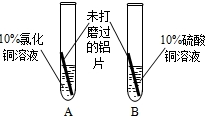 |
 |
 |
| 现 象 | A中铝片表面有红色固体析出; B中铝片无明显现象. |
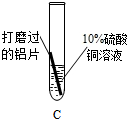
铝片表面有红色固体析出 铝片表面有红色固体析出 溶液由蓝色逐渐变为无色 溶液由蓝色逐渐变为无色 |
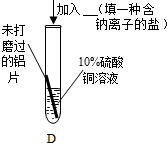
与A中的现象相同 |
| 结 论 | 溶液中对氧化膜产生了破坏作用的离子可能是 氯离子 氯离子 . |
除去表面氧化膜的铝片会与CuSO4溶液反应.该反应 的化学方程式 2Al+3CuSO4═Al2(SO4)3+3Cu 2Al+3CuSO4═Al2(SO4)3+3Cu . |
验证了实验1的结论. |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:初中化学 来源: 题型:
| -2 |
| S |
| -2 |
| S |
| O | 2- 3 |
| O | 2- 3 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?鞍山一模)如图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题.
(2012?鞍山一模)如图是甲、乙两种固体物质的溶解度曲线,试回答下列相关问题.查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| 名称 | 符号 | 原子结构示意图 | 单质的 化学式 |
常温常压下 状态 |
单质与氢气反应 |
| 氟 | F | 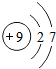 |
F2 | 气态 | 黑暗处爆炸 |
| 氯 | Cl | 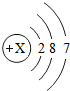 |
Cl2 | 气态 | 光照爆炸 |
| 溴 | Br | 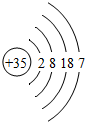 |
Br2 | 液态 | 加热反应 |
| 碘 | I | 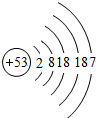 |
I2 | 固态 | 持续加热缓慢反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com