
【题目】右图为甲、乙两种固体物质的溶解度曲线,下列叙述不正确的是
 A.甲、乙两种物质均属于易溶物质
A.甲、乙两种物质均属于易溶物质
B.甲物质的溶液度受温度变化的影响较大
C.在20℃时,甲、乙两种物质的饱和溶液中溶质的质量相等
D.当甲中含有少量的乙时,可用降温结晶法提纯甲
【答案】C
【解析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解:A、在20℃时,两种物质的溶解度相等是30g,大于10g,都是易溶物质,故A正确;
B、由两物质的溶解度曲线不难看出,甲的溶解度受温度的影响较大,故B正确;
C、在20℃时,两物质的溶解度相等,说明两物质的饱和溶液中溶质的质量分数相等,而不能是溶质质量相等,故C错误;
D、由于甲的溶解度随温度的升高而明显增大,而乙的溶解度受温度的影响较小,因此可以通过降温结晶的方法来提纯甲,故D正确;
故选C.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:初中化学 来源: 题型:
【题目】露天烧烤不仅产生大量的有害气体污染环境,而且烧焦的肉类中还含有强烈的致癌物质3,4﹣苯并芘,其化学式为C20H12。
(1)3,4﹣苯并芘分子中C、H原子个数比___;3,4﹣苯并芘的相对分子质量___;
(2)3,4﹣苯并芘中碳元素的质量分数___;(精确到0.1%)
(3)126g3,4﹣苯并芘中含氢元素的质量为___。
查看答案和解析>>
科目:初中化学 来源: 题型:
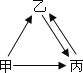
【题目】甲、乙、丙三种物质均含地壳中含量最多的元素.甲、乙是组成元素完全相同 的化合物,丙是单质;乙通常为液体,在一定条件下可分解生成丙;它们之间有如右图所示的转化关系(部分物质和反应条件已经略去).则:
甲的化学式为 ;乙分解生成丙的化学方程式为 .
从微观的角度解释甲、乙性质有差异的原因是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】构建知识网络是一种重要的学习方法。A.B.C.D.E.F.G为常见的物质,其中B.E.G属于单质,反应②是炼铁工业中的主要反应,下图是它们之间的相互转化关系.请回答:

(1)A物质的化学式________
(2)写出反应②的化学方程式_____________;固态C物质在实际生活中的一种用途是____________
(3)写出反应③中生成红色固体的化学方程式________________
(4)写出物质G和A在加热条件下反应的化学方程式_____________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】常温下,向一定量的碳酸钠溶液中不断加入氢氧化钡粉末,溶液质量的变化情况如图所示。对该图的分析有如下几种说法,正确的是
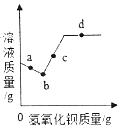
A. 向a点溶液中滴加无色酚酞溶液,溶液变红,可证明有氢氧化钠生成
B. 取少量b点溶液,滴入过量稀盐酸,有气泡产生
C. c点溶液中的溶质只有氢氧化钠
D. 该温度下,向d点溶液中加入氢氧化钡粉末,溶质质量不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
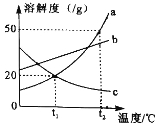
A.随温度升高,a、b、c三种物质的溶解度均增大
B.t2℃时,把50g a放入50g水中,可得到100g a的饱和溶液
C.将t2℃时等质量的a、b饱和溶液降温到t1℃,析出晶体的质量a大于b
D.t1℃时,a、c的溶解度相等,则两溶液的溶质质量分数也相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国科学家侯德榜先生以饱和食盐水、NH3和CO2为原料,发明了“联合制碱法”。该方法中涉及的反应有:①NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,②2NaHCO3![]() Na2CO3+CO2↑+H2O,下列说法不正确的是( )
Na2CO3+CO2↑+H2O,下列说法不正确的是( )
A. 氯化钠属于钠盐,也属于盐酸盐
B. 碳酸氢钠可用于治疗胃酸过多
C. 该生产工艺中二氧化碳可以循环利用
D. 副产品氯化铵作氮肥时,应与碱性物质混合施用
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质的溶解度曲线如图所示。下列说法正确的是_____。
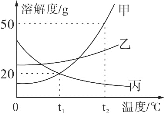
A.甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙
B.将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃析出晶体最多的是甲
C.t2℃时,30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为37.5%
D.欲将丙物质的不饱和溶液变为饱和溶液,可以采取_____(填“升高”或“降低”)温度的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】FeCl3可用作催化剂和外伤止血剂.某实验兴趣小组利用FeCl3腐蚀电路铜板后的溶液(主要成分为FeCl2、CuCl2)进行了氯化铁回收实验。
该实验小组同学通过查阅资料,进行了尝试。
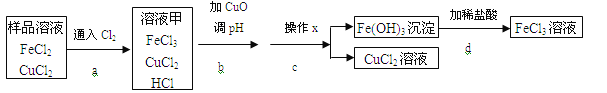
【阅读资料:】
不同金属氢氧化物可以在不同的pH范围内从溶液中沉淀析出,工业上利用调节溶液pH的方法,使金属氢氧化物依次沉淀,结合过滤等操作,进行物质分离。右表是氢氧化铁与氢氧化铜开始沉淀与沉淀完全的pH
[来源:学#科#网]
Fe(OH)3 | Cu(OH)2 | |
开始沉淀的pH | 1.9 | 4.7 |
沉淀完全的pH | 3.2 | 6.7 |
(1)进行操作x时,应用到的仪器有:铁架台、玻璃棒、烧杯和 。
(2)实验中,步骤b加入CuO消耗溶液甲中的HCl,使溶液pH增大到所需范围,请写出盐酸与氧化铜反应的化学方程式 ;你认为步骤b调节溶液的pH到 (填数值范围)比较合适。
(3)实验中,步骤d加稀盐酸前,因缺少 (填操作名称)而使获得的氯化铁溶液不纯。
(4)FeCl3溶液容易生成Fe(OH)3发生变质,在保存FeCl3溶液时,常向FeCl3溶液中加入某种酸,以防止FeCl3溶液变质,你认为选用 (用字母表示)最合理。
A.稀硝酸 B.稀硫酸 C.稀盐酸 D.稀醋酸.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com