
【题目】通过海水晒盐可得到粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如图。
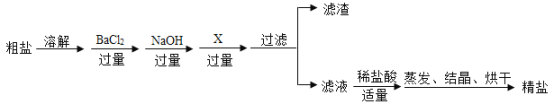
(1)加入过量试剂X的目的是_____。
(2)若在实验操作中,稀盐酸不小心稍加过量了,经分析可知也并不会对精盐有任何影响,原因是___。
【答案】除去溶液中的Ba2+和Ca2+ 盐酸具有挥发性,在蒸发的过程中会挥发掉,蒸发后,固体只剩余的是氯化钠
【解析】
根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀,最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子,进行分析解答。
(1)氯化钡溶液能与硫酸钠溶液反应生成硫酸钡沉淀和氯化钠,氢氧化钠能与氯化镁溶液反应生成氢氧化镁沉淀和氯化钠;钙离子可用碳酸根离子沉淀,可以选用碳酸钠溶液,加入碳酸钠溶液要放在加入的氯化钡溶液之后,这样碳酸钠会除去反应剩余的氯化钡,故X是碳酸钠溶液,加入过量试剂X的目的是除去溶液中的Ba2+和Ca2+。故填:除去溶液中的Ba2+和Ca2+。
(2)完全反应后,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子。若在实验操作中,稀盐酸不小心稍加过量了,经分析可知也并不会对精盐有任何影响,是因为盐酸具有挥发性,在蒸发的过程中会挥发掉。故填:盐酸具有挥发性,在蒸发的过程中会挥发掉,蒸发后,固体只剩余的是氯化钠。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:初中化学 来源: 题型:
【题目】室温时,随着向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2溶液,烧杯内溶液中的溶质质量变化如图所示(忽略溶液温度的变化),下列分析正确的是( )
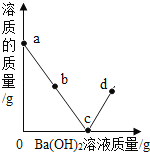
A. a点溶液中有两种溶质
B. b点溶液中滴加紫色石蕊溶液,溶液变蓝
C. c点烧杯内液体的pH=7
D. d点溶液中较多的Ba2+、OH﹣、SO42﹣、H+
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某无色气体可能含有H2、CO、CH4 中的一种或几种,将无色气体在氧气中充分燃烧,将燃烧后的气体通过浓硫酸的装置,质量增加了10.8克,在将剩余气体通过氢氧化钠溶液的装置,质量增加13.2克(假设每一步反应或吸收均完全),下列说法正确的是
A.该气体一定含有H2、CO、CH4 B.该气体可能只含H2、CH4
C.该气体可能只含CO、CH4 D.该气体可能只含CH4
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们用碳酸钠溶液和盐酸的反应验证质量守恒定律,实验后他们对残留废液的成分进行探究。
[推理假设]
上述两种物质发生反应的化学方程式为_______,由此推测出废液中一定有NaCl,可能有_______。
[实验探究]
(1)确定废液中是否含有盐酸:
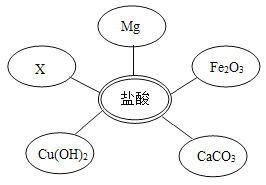
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质x是酸碱指示剂中的_____溶液。
②实验验证:某同学向废液中加入少量的铁粉,观察到_____, 确定废液中一定没有盐酸。
(2)确定废液中是否含有Na2CO3;某同学选用______测出废液的pH=10,确定废液中一定含有Na2CO3。
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计。
方案 | 加入试剂 | 提纯的方法 | 方案评价 |
一 | 适量Ca(NO3)2溶液 | 过滤、 蒸发结晶 | ______(选填可行或不可行) |
二 | 稍过量的______ | ______ | 可行 |
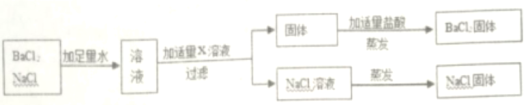
(4)拓展运用:
按如下图方案分离BaCl2和NaCl的固体混合物时,x溶液中溶质是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在研究酸和碱的化学性质时,某同学发现稀H2SO4与NaOH溶液混合后无明显现象产生,于是设计并完成了如下实验方案。
方案一:测定稀H2SO4与NaOH溶液混合前后的pH.
(1)用pH试纸测定NaOH溶液的pH,测得pH___________7 (选填“大于”、“等于”或“小于”);
(2)将定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH, pH=7。
方案二:向盛有NaOH溶液的烧杯中先滴加酚酞试液,后滴加稀硫酸,观察到溶液由红色变成无色。
结论:稀H2SO4与NaOH溶液发生了化学反应;
在上述实验中需要用到溶质质量分数为10%的稀硫酸,现用20g溶质质量分数为98%的浓硫酸进行稀释,则需要增加水的质量为________g, 若实验过程中量水时仰视读数,则会造成所得溶液溶质质量分数_____(选填“偏大”、“不变”或“偏小”)
(3)甲酸(HCOOH)是一种具有挥发性的酸, 甲酸在热的浓硫酸中会分解生成两种氧化物;CO和H2O。如图是制取CO,用CO还原氧化铁并检验气体产物,同时收集尾气中的CO的实验装置。
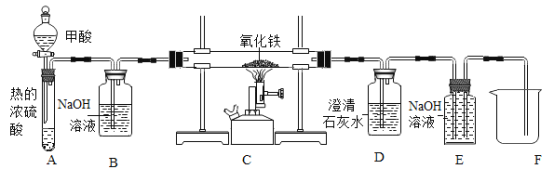
①写出E装置玻璃管内发生反应的化学方程式______。
②若没有B装置,则不能达到检验气体产物的目的,原因是_____。
③E装置可起到收集CO的作用,实验结束时,E中有部分溶液进入到F烧杯中,请设计实验证明该溶液溶质的成分中含有NaOH,写出实验步骤、现象和结论__。
(4)某特种钢村需要用富铁矿石(含铁量高于50%)来冶炼。研学实践小组为测出某地赤铁矿石(主要成分是Fe2O3)中的含铁量,进行实验:取20g赤铁矿石样品,逐渐加入稀盐酸,充分反应。实验相关数据如图所示(假设杂质不溶于水,也不与酸反应)。请计算:
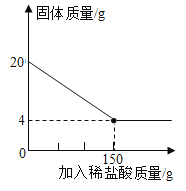
①20g赤铁矿石样品中氧化铁的质量_____。
②计算该样品中铁元素的质量分数,由此判断该赤铁矿石是否属于富铁矿石_____。
③实验中所用稀盐酸溶质的质量分数_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】t℃时,测得某物质(不含结晶水)在不同质量的水中溶解,达到饱和状态时所溶解该物质的质量,绘制成如图中斜线。下列说法正确是
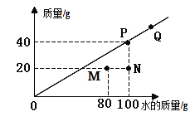
A.该物质的溶解度随温度的升高而增大
B.t℃时该物质的溶解度为40
C.M点表示溶液中溶质的质量分数为25%
D.图中4点表示的溶液中溶质质量分数的关系是:N<M<P=Q
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】中国药学家屠呦呦因为青蒿素的发现成为中国自然科学诺贝尔奖获得者第一人,青蒿素的化学式为C15H22O5。
(1)青蒿素由____________种元素组成;
(2)青蒿素的相对分子质量为_____;
(3)青蒿素中C、H、O的质量比_______;
(4)青蒿素中碳元素的质量分数为_____(精确到0.1%);
(5)100克青蒿素中含氧元素多少克____?(写出计算过程,结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用如下图所示步骤进行实验,其中不能达到实验目的的是( )
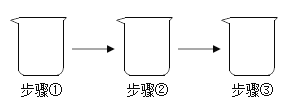
实验目的 | 实验步骤 | |
A | 比较铁、铜的金属活动性强弱 | ①加入铜粉末;②加入适量稀硫酸搅拌;③加入铁片 |
B | 检验NaCl中混有Na2CO3 | ①加入少量样品;②加入适量水至全部溶解; ③加入适量稀盐酸 |
C | 验证KCl不能无限溶解 | 20°C时,①加入100g水;②加入18gKCl搅拌;③加入16gKCl搅拌(已知:20℃时,KCl的溶解度为34g) |
D | 配置50g溶质质量分数为5%的氯化钠溶液 | ①加入2.5gNaCl;②加入47.5g水;③搅拌至全部溶解 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com