
分析 首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
解答 解:(1)正常雨水呈酸性,是因为二氧化碳与水反应生成碳酸,反应的化学方程式为:CO2+H2O═H2CO3.
(2)用石灰浆粉刷墙壁,干燥后墙面变硬,是因为氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
故答案为:(1)CO2+H2O═H2CO3;(2)CO2+Ca(OH)2═CaCO3↓+H2O.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.


 53随堂测系列答案
53随堂测系列答案科目:初中化学 来源: 题型:解答题
| 实验 | 操作步骤 | 现象 | 结论 |
| Ⅰ | 取出烛芯内的打火石,用砂纸打磨 | 金属是银白色 | 该金属一定不是铜 |
| Ⅱ | 取少量打磨后的打火石于小试管中,滴加适量稀硫酸,观察现象 | 金属逐渐溶解,有无色气体产生,溶液为无色 | 该金属一定不是铁 |
| Ⅲ | 取少量打磨后的打火石于小试管中,加入适量的氯化铜溶液,观察现象 | 有红色物质析出 | 该金属可能是镁 |

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 有3种元素组成 | B. | 摩尔质量为148 | ||
| C. | 氧元素的质量分数最少 | D. | 1mol分子中含有19个原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
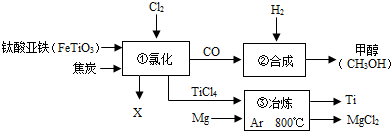
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
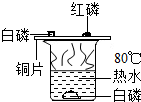 化学课上我们曾经观察过如图所示的实验.
化学课上我们曾经观察过如图所示的实验.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
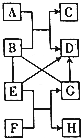 A--H是初中化学常见的物质,它们能相互转化关系如图所示,图中“→”表示转化关系,“-”表示相互能反应(部分物质和反应条件为标出).已知D是人体中含量最多的物质,F可用于改良酸性土壤,且与G属于同类
A--H是初中化学常见的物质,它们能相互转化关系如图所示,图中“→”表示转化关系,“-”表示相互能反应(部分物质和反应条件为标出).已知D是人体中含量最多的物质,F可用于改良酸性土壤,且与G属于同类查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
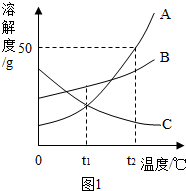 溶解是生活中常见的现象.
溶解是生活中常见的现象.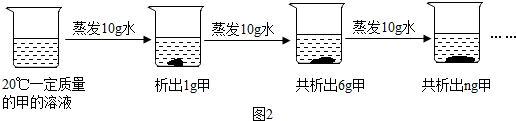
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com