
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图所示,密闭玻璃管中,在A支管内放入5g镁粉,在B支管中放入KClO3和MnO2的混合物.将A、B支管同时加热,使两管内物质完全反应,若反应前后管内空气成分未发生变化,求最初放入B支管中的KClO3是多少克?
如图所示,密闭玻璃管中,在A支管内放入5g镁粉,在B支管中放入KClO3和MnO2的混合物.将A、B支管同时加热,使两管内物质完全反应,若反应前后管内空气成分未发生变化,求最初放入B支管中的KClO3是多少克?查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁. | 试管外壁发热 | 原因是氢氧化钠固体溶于水放热 |
| ②向①所得的溶液中逐滴加入稀硝酸至过量 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体. | 样品中含有的杂质是碳酸钠 |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有的杂质是氯化钠 |
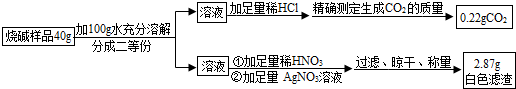
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验 | 30%双氧水的质量(g) | 加入的水的体积(mL) | 二氧化锰质量(g) | 收集时间(s) |
| 1 | 10 | 40 | 5 | 200 |
| 2 | 20 | 30 | 5 | 100 |
| 3 | 30 | 20 | 5 | 67 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com