


分析 ①石灰石中的碳酸钙在高温条件下分解生成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠;
②浓氢氧化钠溶液实验前后质量的质量差即为碳酸钠和稀硫酸反应生成二氧化碳的质量,根据二氧化碳质量可以计算碳酸钠质量,进一步可以计算氢氧化钠质量,氢氧化钠质量和固体样品的质量比值即为该样品中氢氧化钠的质量分数;
氢氧化钠溶液能够吸收空气中的二氧化碳气体.
解答 解:①Ⅰ.白色固体是氧化钙,加入纯碱溶液后,氧化钙和其中的水反应生成氢氧化钙,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,所有发生的化学反应的化学方程式为:CaO+H2O═Ca(OH)2,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
故填:CaO+H2O═Ca(OH)2,Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
Ⅱ.滤液中存在少量的Na2CO3,可以用适量的氢氧化钙试剂去除该物质,因为适量的氢氧化钙能和碳酸钠反应生成碳酸钙和氢氧化钠,过滤可以除去碳酸钙沉淀.
故填:氢氧化钙.
②Ⅰ.浓氢氧化钠溶液实验前后质量的质量差即为碳酸钠和稀硫酸反应生成二氧化碳的质量,根据二氧化碳质量可以计算碳酸钠质量,进一步可以计算氢氧化钠质量,氢氧化钠质量和固体样品的质量比值即为该样品中氢氧化钠的质量分数.
故填:AC.
Ⅱ.D装置的作用是防止空气中的二氧化碳加进入C中;
没有D装置时,空气中的二氧化碳能够被C装置中的氢氧化钠溶液吸收,导致测定的碳酸钠质量偏大,从而使计算的氢氧化钠质量偏小,进一步导致计算的氢氧化钠质量分数偏小.
故填:防止空气中的二氧化碳加进入C中;偏小.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:初中化学 来源: 题型:解答题
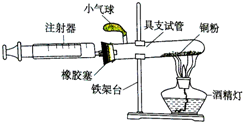 某化学兴趣小组在实验室利用自己设计的装置(如图)测定空气中氧气的含量.
某化学兴趣小组在实验室利用自己设计的装置(如图)测定空气中氧气的含量.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验编号 | 温度 | 催化剂 | 质量分数 | |
| 甲组实验Ⅰ | 25℃ | 二氧化锰 | 10mL 2%H2O2 | |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
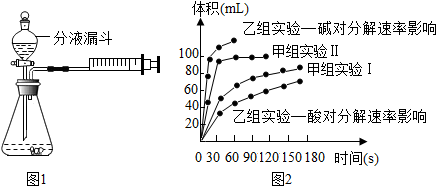
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 组合序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 组合物质 | H2SO4 NaOH | H2SO4 NaCl | H2SO4 Na2CO3 | H2SO4 Ba(NO3)2 | NaOH Ba(NO3)2 | Na2CO3 Ba(NO3)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
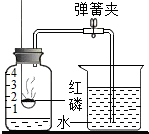 测定空气中氧气体积分数的实验装置如图所示,在集气瓶内加入少量的水,并五等分水面以上的容积,做上记号.用弹簧夹夹紧乳胶管,点燃燃烧匙内稍过量的红磷后,立即伸入瓶中并把塞子塞紧,看到的现象是①红磷燃烧,冒出大量的白烟;
测定空气中氧气体积分数的实验装置如图所示,在集气瓶内加入少量的水,并五等分水面以上的容积,做上记号.用弹簧夹夹紧乳胶管,点燃燃烧匙内稍过量的红磷后,立即伸入瓶中并把塞子塞紧,看到的现象是①红磷燃烧,冒出大量的白烟;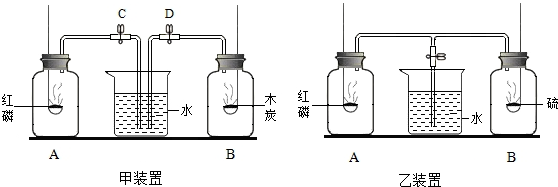
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| ①酸与指示剂作用 | 酸溶液能使紫色石蕊溶液变红色 | 酸溶液不能使无色酚酞溶液变色 |
| ②酸与活泼金属作用 | Fe+2HCl=FeCl2+H2↑ | Fe+H2SO4=FeSO4+H2↑ |
| ③酸与某些金属氧化物作用 | Fe2O3+HCl=FeCl3+H2O | … |
| ④… |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com