
 如下:
如下:| 实验步骤 | 实验现象 | 化学方程式 |
| 取一只250mL的集气瓶,用排水法收集一瓶所带气体,然后把一小块燃着的木炭插入集气瓶中 | 木炭燃烧得更旺, 然后慢慢熄灭 | 化学方程式I |
 【实验结论】收集的气体是纯净的氧气.
【实验结论】收集的气体是纯净的氧气.| 实验操作 | 主要实验现象 | 实验结论及解释 | |
| ① | 检查装置的气密性 | 装置的气密性良好 | |
| ② | 加入药品,将装置连接固定 | ||
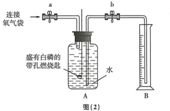
| ③ | 打开止水夹a和b,向A中缓慢鼓入一定量气体后关闭止水夹a和b | A中水进入到B中,B中水的体积为200mL. | 收集200mL气体(由压强差引起的误差忽略不计) |
| ④ | 用凸透镜聚光引燃白磷 | 燃烧,产生大量白烟 | |
| ⑤ | 待白磷熄灭并冷却到室温,进行操作I | 现象I | 小丽收集的气体不是纯净的氧气 |
| 实验次序 | 1 | 2 | 3 | 4 | 5 |
| B中剩余水体积/mL | 100 | 42 | 39 | 41 | 38 |
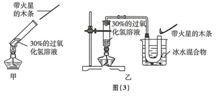 (1)写出甲装置中反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,在甲的实验现象中带火星的木条往往难以复燃,改用乙装置后能使带火星的木条复燃,请解释原因:由于在加热分解过氧化氢生成氧气的同时,也生成了大量的水蒸气,因此带火星的木条很难复燃.
(1)写出甲装置中反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,在甲的实验现象中带火星的木条往往难以复燃,改用乙装置后能使带火星的木条复燃,请解释原因:由于在加热分解过氧化氢生成氧气的同时,也生成了大量的水蒸气,因此带火星的木条很难复燃.| 第一组 | 第二组 | 第三组 | |||||||||
| 集气瓶编号 | ① | ② | ③ | ④ | ⑤ | ① | ② | ③ | ④ | ⑤ | ① |
| 收集的O2占容积的体积分数(%) | 10 | 20 | 30 | 40 | 50 | 31 | 33 | 35 | 37 | 39 | 34 |
| 带火星木条的状况 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 | 很亮 | 很亮 | 复燃 | 复燃 | 复燃 | 很亮 |
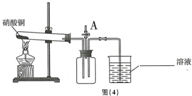 A处的止水夹,将带火星的木条放在导管口,复燃,于是他得出结论硝酸铜分解生成了氧气.
A处的止水夹,将带火星的木条放在导管口,复燃,于是他得出结论硝酸铜分解生成了氧气.分析 实验I:【实验记录】:根据木条燃烧的反应原理书写方程式;
【实验反思】:木炭在集气瓶中燃烧得更旺只能说明集气瓶中氧气的含量高于空气中氧气的含量,不能说明集气瓶中氧气含量为100%;
实验II:【实验记录】:根据利用白磷燃烧测定氧气含量的原理回答:装置A中进入水的体积就是氧气的体积;
【数据处理】:为了缩小误差,可求出另外4次的平均值作为最终结果,则小丽所带气体中氧气的体积为200mL-(42mL+39mL+41mL+38mL)÷4=160mL,并进一步计算出氧气的体积分数;
【实验反思】:(1)根据题意并结合物理变化和化学变化的判断依据分析解答;
(2)第1组数据较大,说明氧气没有被消耗完,最可能的情况就是白磷量不足,不足以消耗所有的氧气;
【拓展探究】(1)根据过氧化氢在二氧化锰的催化作用下生成水和氧气,由于在加热分解过氧化氢生成氧气的同时,也生成了大量的水蒸气,带火星的木条很难复燃进行分析;
(2)根据表格可发现收集的氧气占容积的体积分数最低为35%时木条也可复燃,根据空气中原有的氧气和收集到的氧气,就可算出氧气的分数;
【设计实验】根据硝酸铜在加热的条件下生成氧化铜、二氧化氮和氧气进行分析;
【实验反思】(1)根据空气中氧气占21%,带火星的木条都不能复燃,本实验中氧气的浓度只占混合气的20%,也生成了二氧化氮气体等知识进行分析;
(2)根据二氧化氮是空气污染性气体进行分析.
解答 解:实验I:【实验记录】木炭在氧气中充分燃烧,生成二氧化碳气体,故反应的化学方程式为 C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2;
【实验反思】根据实验现象“木炭燃烧得更旺”可知,集气瓶中的氧气浓度很高,但不一定是纯净的氧气;
实验II:
【实验记录】结合空气中氧气含量的测定分析,由于白磷能与氧气反应,故反应后,集气瓶中因氧气的减少而使压强变小,待白磷熄灭并冷却到室温时,打开止水夹b,会看到B中部分水被吸入A中;
【数据处理】根据题意,由于第1组数据偏差较大,存在明显误差,故在数据处理时已删去;为了进一步缩小误差,可求出另外4次的平均值作为最终结果,则小丽所带气体中氧气的体积为200mL-(42mL+39mL+41mL+38mL)÷4=160mL,故氧气的体积分数=$\frac{160mL}{200mL}$×100%=80%;
【实验反思】
(1)根据题意可知,这台家用制氧机在制氧气的过程中,只是将空气中的氮气和氧气分离,而没有新物质生成,故发生的变化属于物理变化;
(2)根据题意可知,B中剩余的水越多,说明消耗的氧气越少,压强变化小,倒吸的水也就少,所以第1组数据较大,说明氧气没有被消耗完,最可能的情况就是白磷量不足,不足以消耗所有的氧气;
【拓展探究】(1)过氧化氢在二氧化锰的催化作用下生成水和氧气,化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
由于在加热分解过氧化氢生成氧气的同时,也生成了大量的水蒸气,带火星的木条很难复燃;
(2)由图中可知,当氧气的体积分数达到35%时,带火星的木条复燃,即收集的氧气占容积的体积分数最低为35%,此时空气还占65%,所以空气中有氧气的量为:65%×21%≈14%,所以此时瓶内共有氧气的分数为14%+35%=49%;
【设计实验】硝酸铜在加热的条件下生成氧化铜、二氧化氮和氧气,化学方程式为:2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑;
【实验反思】(1)空气中氧气占21%,带火星的木条都不能复燃,本实验中氧气的浓度只占混合气的20%,也生成了二氧化氮气体,所以从硝酸铜分解得到的气体能使带火星的木条复燃这一事实,不能说明一定生成了氧气,理由是:空气中氧气的浓度是21%,带火星的木条并没有复燃,本实验中氧气的浓度只占混合气的20%,本实验得出的结论是:二氧化氮支持燃烧,设计的实验是:只需要将带火星的木条伸入二氧化氮气体中,如果复燃,即可证明;
(2)二氧化氮是空气污染性气体,所以为了防止二氧化氮逸出而环境污染,所以烧杯中应该放入氢氧化钠溶液.
故答案为:
实验I:【实验记录】C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2;
【实验反思】木炭在集气瓶中燃烧得更旺只能说明集气瓶中氧气的含量高于空气中氧气的含量,不能说明集气瓶中氧气含量为100%;
实验II:【实验记录】打开止水夹b,B中部分水被吸入A中;
【数据处理】80%;
【实验反思】(1)物理变化;
(2)白磷量不足;
【拓展探究】(1)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
由于在加热分解过氧化氢生成氧气的同时,也生成了大量的水蒸气,带火星的木条很难复燃;
(2)35,49;
【设计实验】2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑;
【实验反思】(1)不能,空气中氧气的浓度是21%,带火星的木条并没有复燃,本实验中氧气的浓度只占混合气的20%,二氧化氮支持燃烧,只需要将带火星的木条伸入二氧化氮气体中,如果复燃,即可证明;
(2)氢氧化钠.
点评 对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等.


科目:初中化学 来源:【全国市级联考】安徽省合肥市2017届九年级中考第一次模拟考试化学试卷 题型:选择填充题
除贡外金属常温下为固体,清华大学刘静教授制造的镓铟这两种金属的合金即使在室温下也能保持液态,而且具有很多神奇特性。下图为镓、铟元素在周期表中的信息。下列有关说法错误的是:
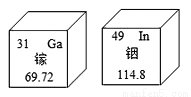
A. 镓原子的核电核数比铟原子少18
B. 铟原子相对原子质量为114.8
C. 镓原子的中子数为31
D. 合金的溶点比组成合金的金属低
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 安全火柴的火柴头上主要含有氯酸钾、二氧化锰、硫磺和玻璃粉等.火柴杆上涂有少量石蜡.火柴盒侧面的摩擦层由红磷和玻璃粉调和而成.
安全火柴的火柴头上主要含有氯酸钾、二氧化锰、硫磺和玻璃粉等.火柴杆上涂有少量石蜡.火柴盒侧面的摩擦层由红磷和玻璃粉调和而成. 查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| X盐溶液 | Y盐溶液 | Z盐溶液 | |
| Ni | 无 | 无 | 有 |
| Mn | 无 | 有 | 有 |
| A. | X Mn Y Ni Z | B. | Z Ni Y Mn X | ||
| C. | Z Mn Y Ni X | D. | X Mn Ni Y Z |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | X=Y | B. | X<Y | C. | X>Y | D. | 无法比较 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com