
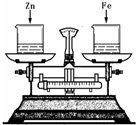
 如图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌粉和铁粉,则从反应开始到金属完全反应的过程中,下列现象不可能观察到的是
如图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌粉和铁粉,则从反应开始到金属完全反应的过程中,下列现象不可能观察到的是 g
g  g
g

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
 如图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )
如图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )| A、向左偏 | B、向右偏 | C、先向左偏后向右偏 | D、先向右偏后向左 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
 如图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌粉和铁粉,则从反应开始到金属完全反应的过程中,下列现象不可能观察到的是( )
如图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌粉和铁粉,则从反应开始到金属完全反应的过程中,下列现象不可能观察到的是( )查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?香坊区二模)如图所示的烧杯中盛有一定量的稀硫酸,溶液中漂浮一个塑料块.请回答:
(2012?香坊区二模)如图所示的烧杯中盛有一定量的稀硫酸,溶液中漂浮一个塑料块.请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com