
100 g某硫酸溶液恰好与13 g锌完全起反应,试计算这种硫酸溶液中溶质的质量分数。
19.6%
【解析】考点定位分析:本题的考点是根据化学反应方程式的计算,有关溶质质量分数的简单计算。根据化学反应方程式的计算的步骤一般分为六步:
1.设未知量,即---的质量为x;
2.书写用到的化学方程式(即写→配→标→注),特别是化学方程式的配平是至关重要的;
3.将用到的物质的质量关系标注在相应的化学式的正下方;上行是相对质量关系(即利用相对原子质量或相对分子质量乘以相应的化学计量数得来的),下行是纯物质质量(即已知量和未知量x);
4.列计算用到比例式,即上行的相对质量比等于下行的实际质量比;
5.求算结果,注意一定要有单位;
6.写出简明的答案,一般是问什么就答什么。
解答过程分析:此题是溶液计算与化学方程式计算的综合运用,硫酸溶液中的溶质就是参加了化学反应的硫酸,所以先求纯硫酸质量。
设溶液中硫酸质量为x
Zn+H2SO4=ZnSO4+H2↑
65 98
13 g x
 得x=
得x=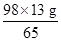 =19.6 g
=19.6 g
所以这种硫酸溶液中w(H2SO4)=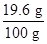 ×100%=19.6%
×100%=19.6%
试题总结评价:此题是有关化学方程式、溶质质量分数结合起来的综合题,解题的关键是要弄清楚反应前的溶液中的溶质是什么,如何求该溶液中溶质质量和溶液质量。一般说来,溶质质量可利用化学方程式进行计算,再结合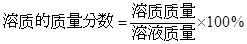 ,即可计算。
,即可计算。


 优加精卷系列答案
优加精卷系列答案科目:初中化学 来源:2008年广东省湛江市初中毕业升学统一考试、化学试卷 题型:038
钢铁工业是国家工业的基础.2007年我国粗钢产量接近5亿吨,居世界前列.湛江的东海岛也将建设千万吨钢铁厂,这将给湛江的经济带来质的飞跃.某校兴趣小组取某种钢样进行试验,请计算:
(1)取钢样(假设只含铁单质和碳单质)粉末100 g,在氧气中充分燃烧,得到CO2气体4.4 g,此钢样粉末中碳的质量分数为________(保留到0.1%).
(2)分别向四份不同质量的钢样粉末中加入100 g稀硫酸溶液,充分反应后,测得的实验数据如下表所示:
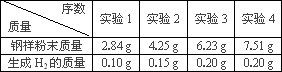
①计算硫酸溶液中溶质的质量________g
②求在实验3中溶液的溶质质量分数?
查看答案和解析>>
科目:初中化学 来源:2010-2011学年江苏省南京市雨花区初三第一次模拟考试化学试卷 题型:计算题
“黄铜”是铜锌合金,具有较好机械性能,比纯铜耐腐蚀,街头许多“金色”饰品就是用它来制作的.现取20.0 g某种黄铜投入100 g某稀硫酸中,恰好完全反应后剩余的溶液和残余固体总质量为119.8 g.请计算:
(1)产生氢气的质量为____g.
(2)这种黄铜中铜的质量分数是多少?
(3)剩余溶液中溶质的质量分数是多少?(结果精确到0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com