(2009?防城港)常温下,把碳酸钠和氯化钠组成的固体混合物18.9g放人烧杯中,然后加入50g水,不断搅拌至全部溶解,制成溶液.往其中逐渐滴加溶质质量分数为10%的稀盐酸,当用去73g稀盐酸时,恰好完全反应.请你根据题意回答下列问题:
(1)碳酸钠和稀盐酸恰好完全反应时,溶液的pH=______.
(2)如何用反应后所得溶液配制成溶质质量分数为10%的溶液?请你通过计算来说明.
【答案】
分析:(1)只要酸碱发生了反应就叫中和,判断是否完全中和是以酸碱是否恰好完全反应作为标准的,进行解答;
(2)正确运用溶质质量分数的表达式;溶液稀释前后,溶质 的质量保持不变,进行分析解答;
根据化学反应方程式进行计算出溶质质量和溶液质量,求出所得溶液中溶质质量分数;
通过比较,再配制成溶质质量分数为10%的溶液,进行分析解答.
解答:答:(1)碳酸钠和稀盐酸恰好完全反应时,溶液的pH=7;故答案为:7;
(2)设18.9g混合物中碳酸钠的质量为x,它与稀盐酸反应生成氯化钠的质量为y,生成二氧化碳的质量为z.则
Na
2CO
3 +2HCl═2NaCl+CO
2↑+H
2O
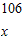


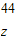

;x=10.6g

;y=11.7g

;z=4.4g
所得溶液中溶质质量=18.9g-10.6g+11.7g=20g
所得溶液的质量=18.9g+73g+50g-4.4g=137.5g
所得溶液中溶质质量分数=
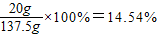
因为所得溶液中溶质质量分数为14.54%,大于所要配制的溶液的溶质质量分数(10%),所以要加水稀释.
设加水的质量为W.则
(137.5g+W)×10%=20g
W=62.5g
答:应往所得溶液加入62.5g水,搅拌均匀后可配制成溶质质量分数为10%的溶液.
点评:本题考查的是关于溶液的增浓、稀释问题的有关计算,问题的关键是稀释前后,溶液中溶质的质量不变,要正确运用溶质质量分数的表达式,进行解题.

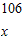


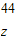
 ;x=10.6g
;x=10.6g ;y=11.7g
;y=11.7g ;z=4.4g
;z=4.4g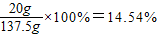


 名校课堂系列答案
名校课堂系列答案
 NaHCO3↓+NH4Cl
NaHCO3↓+NH4Cl