
| 加入NaOH溶液的质量/g | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
| 生成沉淀的质量/g | 0.0 | 0.00 | 2.45 | 4.90 | 4.90 |
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 葡萄糖注射液5% [规格]500ml [适应症]补充能量和体液及全静脉内营养 龙江市制药二场厂 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
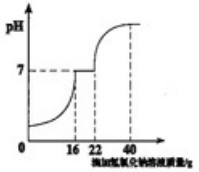
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
| 猜想 | 实验步骤 | 实验现象及结论 |
| | | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
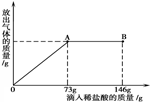
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com