
分析 (1)铜、铁、铝三种金属活动性由强到弱的顺序为:铝>铁>铜;对比人类利用金属的历史:先有青铜器时代再到铁器时代,然后才有了铝制品;可以发现二者存在一定联系,同时不同时期人们对金属的冶炼方法和水平不同,也导致人们使用的金属材料不同.
(2)根据铝制品表面有一层氧化铝保护膜进行解答;
解答 解:(1)对比金属活动性强弱关系与人类利用金属的先后,可以发现人类使用较早的金属,其活动性较弱;结合学习中对金属铁、铝的冶炼的认识,可知:金属活动性越强,金属的冶炼难易程度越难,这也影响了人类对金属的使用.
故答案为:金属活动性.
(2)铝制的水壶不用钢丝球洗铝锅,是因为会刷去表面的氧化铝薄膜;
故答案为:钢丝球会刷去表面的氧化铝薄膜.
点评 本题考查学生利用所学的化学知识解释生活中现象,及在生活的应用.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:选择题
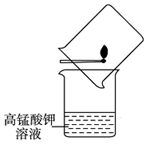 教材上有这么一个实验:将含硫火柴在盛有高锰酸钾溶液的烧杯上方点燃,并用另一烧杯罩住火柴,如图所示.下列关于该实验的说法中不正确的是( )
教材上有这么一个实验:将含硫火柴在盛有高锰酸钾溶液的烧杯上方点燃,并用另一烧杯罩住火柴,如图所示.下列关于该实验的说法中不正确的是( )| A. | 硫燃烧时发生了化学变化 | |
| B. | 高锰酸钾溶液褪色,说明发生了化学变化 | |
| C. | 生成的二氧化硫是主要大气污染物之一 | |
| D. | 应积极提倡使用含硫火柴 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
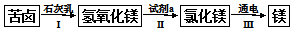

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
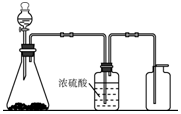 如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是B(填正确选项的标号).
如图是一套实验室制气装置,用于发生、干燥和收集气体.下列各组物质中能利用这套装置进行实验的是B(填正确选项的标号).查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
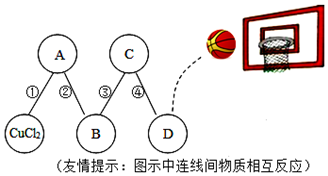
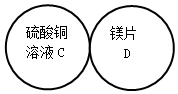 用四个圆表示A(铁片)、B(稀硫酸)、C(硫酸铜溶液)、D(镁片)四种物质,用两圆相切表示两种物质可以发生反应,如图所示.请回答下列问题:(提示:物质间均恰好完全反应,其中稀硫酸与硫酸铜溶液不反应)
用四个圆表示A(铁片)、B(稀硫酸)、C(硫酸铜溶液)、D(镁片)四种物质,用两圆相切表示两种物质可以发生反应,如图所示.请回答下列问题:(提示:物质间均恰好完全反应,其中稀硫酸与硫酸铜溶液不反应)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量的纯碱溶液,请在图中画出溶液的pH随滴入纯碱的量的大概变化图象,并解释各段变化的理由.
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量的纯碱溶液,请在图中画出溶液的pH随滴入纯碱的量的大概变化图象,并解释各段变化的理由.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com