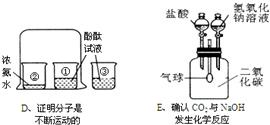
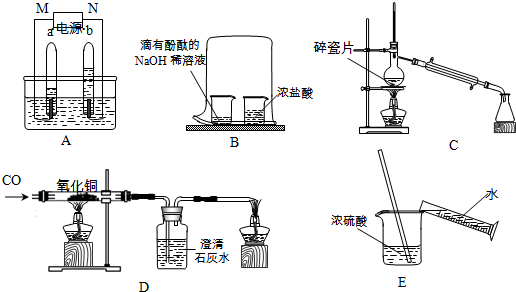
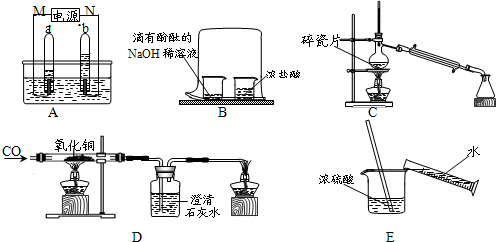
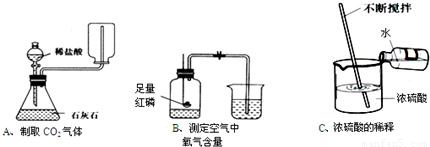
解:(1)电解水时负极产生氢气,正极产生氧气,且体积比是2:1,可知M极连通的试管气体较多是氢气,所以M极是负极;
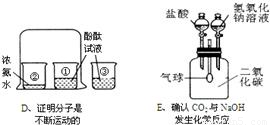
(2)该实验证明的是分子的运动,出现的现象是滴有酚酞的氢氧化钠溶液红色逐渐褪去,证明了HCl分子的运动,也证明了氢氧化钠与盐酸能够反应,同时还证明了酚酞遇碱会变红的结论;;
(3)依据制取蒸馏水烧瓶中的水容易暴沸导致水从冷凝管喷出,加入碎瓷片能较好的防止水的暴沸;
(4)依据各步发生的化学反应以及化学方程式的书写可知:三处的化学反应方程式是:①CO+CuO

Cu+CO
2②CO
2+Ca(OH)
2═CaCO
3↓+H
2O③2CO+O
2
2CO
2
(5)浓硫酸溶于水会放出大量的热,从而导致水沸腾使酸液飞溅,造成事故的发生;
故答案为:(1)负(2)浓盐酸易挥发;分子是不断运动(3)防止烧瓶中的水暴沸(4)CO+CuO

Cu+CO
2;CO
2+Ca(OH)
2═CaCO
3↓+H
2O;2CO+O
2
2CO
2(5)酸液飞溅
分析:(1)依据电解水时现现分析解答;
(2)依据该实验的目的及进行的过程,并结合物之间的反应关系分析判断;
(3)依据制取蒸馏水对水的沸腾控制分析解决;
(4)依据各步进行的化学反应以及化学方程式的书写原则完成即可;
(5)根据浓硫酸溶于水会放出大量的热分析判断;
点评:本题中的实验都是基本实验,涉及到反应条件,反应现象,反应注意事项.考查了洗气的方法、氧气的含量测定、蒸发食盐水、氨气的挥发性实验、二氧化碳与氢氧化钙的反应,知识点多,对实验的正误要有较高的判断能力.


 Cu+CO2②CO2+Ca(OH)2═CaCO3↓+H2O③2CO+O2
Cu+CO2②CO2+Ca(OH)2═CaCO3↓+H2O③2CO+O2 2CO2
2CO2 Cu+CO2;CO2+Ca(OH)2═CaCO3↓+H2O;2CO+O2
Cu+CO2;CO2+Ca(OH)2═CaCO3↓+H2O;2CO+O2 2CO2(5)酸液飞溅
2CO2(5)酸液飞溅

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案