
| 次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入盐酸的质量/g | 20 | 20 | 20 | 20 | 20 |
| 剩余固体的质量/g | 25 | a | 15 | 10 | 10 |
分析 本题重在分析数据的有效性.样品是30g,加入第一个20g盐酸的时候,剩余固体是25g,说明反应掉的碳酸钙的质量为5g.根据后面的数据可知此时碳酸钙应该有剩余,也就是20g盐酸和5g碳酸钙是恰好完全反应.所以第二次再加20g盐酸,反应掉的碳酸钙还可能是5g,即还剩余20g固体,根据后面的固体质量可知,第二次应该也是反应掉5g.剩余20g.即a=20g.第三次加入20g盐酸,是从剩余的20g固体减少为15g,第四次加入20g盐酸,是从剩余的15g固体减少为10g,第五次加入20g盐酸,固体不再减少,说明此时第四次恰好完全反应,最后的10g不含碳酸钙成分.题目中要计算反应所以溶液中溶质的质量分数,就需要求溶质和溶液的总质量.
解答 解:(1)样品是30g,加入第一个20g盐酸的时候,剩余固体是25g,说明反应掉的碳酸钙的质量为5g.根据后面的数据可知此时碳酸钙应该有剩余,也就是20g盐酸和5g碳酸钙是恰好完全反应.所以第二次再加20g盐酸,反应掉的碳酸钙还可能是5g,即还剩余20g固体,根据后面的固体质量可知,第二次应该也是反应掉5g.剩余20g.即a=20g.
(2)第三次加入20g盐酸,是从剩余的20g固体减少为15g,第四次加入20g盐酸,是从剩余的15g固体减少为10g,第五次加入20g盐酸,固体不再减少,说明此时第四次恰好完全反应,最后的10g不含碳酸钙成分,所以样品中碳酸钙的质量是30g-10g=20g
(3)第4次实验后生成的CaCl2的质量为x,生成二氧化碳的质量为y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
20g x y
$\frac{100}{20g}$=$\frac{111}{x}$=$\frac{44}{y}$
x=22.2g,y=8.8g
第4次实验后生成的CaCl2溶液的溶质质量分数是$\frac{22.2g}{80g+20g-8.8g}$×100%=24.4%
答:第4次实验后生成的CaCl2溶液的溶质质量分数是24.4%.
点评 在有表格的计算中,我们要根据表格中所给的数据分析并得出我们所需要的物质的质量,然后再利用化学方程式进行计算.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
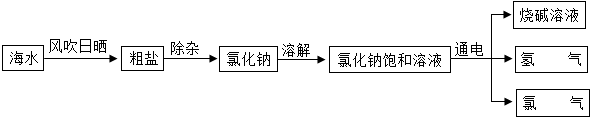
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
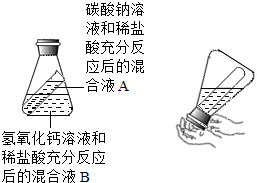 甲、乙两同学在学完酸的化学性质后,分别做了如下两个实验A、B.然后,他们又将各自的混合液混合.(先将锥形瓶慢慢倒转,使试管中的A液体流入锥形瓶B液体中)
甲、乙两同学在学完酸的化学性质后,分别做了如下两个实验A、B.然后,他们又将各自的混合液混合.(先将锥形瓶慢慢倒转,使试管中的A液体流入锥形瓶B液体中)查看答案和解析>>
科目:初中化学 来源: 题型:解答题
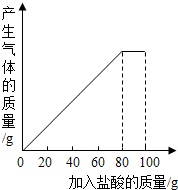 有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到30g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象.
有一种石灰石样品的成分是CaCO3和SiO2.课外小组同学将100g盐酸分5次加入到30g石灰石样品中(已知SiO2不与盐酸反应),得到如下部分数据和图象.| 次数 | 第1次 | 第2次 | 第3次 |
| 加入盐酸的质量/g | 20 | 20 | 20 |
| 剩余固体的质量/g | 25 | a | 15 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 世界环保联盟建设全面禁止用氯气(常温下是一种黄绿色有毒气体)对饮用水消毒,推广使用安全、高效杀菌消毒剂ClO2.ClO2是一种黄绿色,有刺激性气味的气体,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解,易与碱反应,杀菌、漂白能力均优于氯气.
世界环保联盟建设全面禁止用氯气(常温下是一种黄绿色有毒气体)对饮用水消毒,推广使用安全、高效杀菌消毒剂ClO2.ClO2是一种黄绿色,有刺激性气味的气体,冷却至11.0℃以下时变成红色液体,易溶于水,见光易分解,易与碱反应,杀菌、漂白能力均优于氯气.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

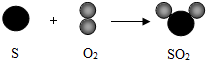
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com