
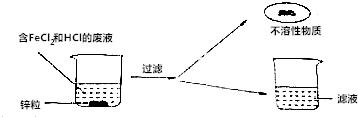
分析 根据物质的性质以及物质间的反应进行分析解答,氯化亚铁的水溶液为浅绿色,据此解答.
解答 解:(1)锌能与盐酸反应生成氯化锌和氢气,能与氯化亚铁反应生成氯化锌和铁,故所得的不溶物中一定含有铁;故填:Fe;
(2)因为铁能与盐酸反应,有铁剩余,故一定不会有盐酸剩余,故填:铁能与盐酸反应;
(3)氯化亚铁的水溶液为浅绿色,故观察颜色即可判断有无氯化亚铁剩余,故填:氯化亚铁的水溶液为浅绿色;
【实验拓展】若滤液中含有两种溶质,则是氯化锌和氯化亚铁的混合物,需要将氯化亚铁除去,可以加入过量的锌除去氯化亚铁,然后过滤,将滤液蒸干即可,故填:锌,蒸干.
点评 掌握常见的金属的性质以及物质进行的反应是正确解答本题的关键.


科目:初中化学 来源: 题型:多选题
| A. | 氢氧化钠 | B. | 水 | C. | 硫酸钾溶液 | D. | 碳酸钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验方案 | 实验步骤 | 预期现象 | 结论 |
| 方案1 | 取样,滴入适量的硝酸钡溶液 | 出现白色沉淀 | 有硫酸 |
| 方案2 | 取样,滴入盛有锌粒的试管中 | 有气泡产生 | 有硫酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 乙炔(C2H2)气体可由碳化钙固体(CaC2)与水反应生成制得,同时生成一种白色固体.
乙炔(C2H2)气体可由碳化钙固体(CaC2)与水反应生成制得,同时生成一种白色固体.| 实验步骤 | 实验现象 | 实验结论 |
| 取少量的白色固体加入稀盐酸 | 没有气泡生成 | 白色固体不是碳酸钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com