
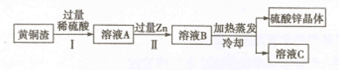
分析 (1)铜不能和稀硫酸反应,稀硫酸能和锌反应生成硫酸锌和氢气,能和氧化锌反应生成硫酸锌和水,能和氧化铜反应生成硫酸铜和水,能和铁反应生成硫酸亚铁和氢气;
(2)锌比铜活泼,能和硫酸铜反应生成硫酸锌和铜;
(3)步骤Ⅰ、Ⅱ中均包含的操作是过滤,通过过滤能够把液体和固体分离;
析出晶体后的溶液是该晶体的饱和溶液.
(4)黄铜在日常生产生活中可以用来制作无缝铜管.
解答 解:(1)铁能和稀硫酸反应生成硫酸亚铁和氢气,因此证明步骤Ⅰ中稀硫酸过量的方法是:取少量溶液于试管中,加入铁粉,产生气泡.
故填:取少量溶液于试管中,加入铁粉,产生气泡.
(2)步骤Ⅱ中,锌和硫酸铜反应生成硫酸锌和铜,和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为:Zn+CuSO4═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑.
故填:Zn+CuSO4═ZnSO4+Cu,或Zn+H2SO4═ZnSO4+H2↑.
(3)步骤Ⅰ、Ⅱ中均包含的操作是过滤;
得到的溶液C一定是硫酸锌的饱和溶液.
故填:过滤;一定.
(4)黄铜在日常生产生活中可以用来制作无缝铜管.
故填:制作无缝铜管.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 加入金属铜片,产生气泡 | B. | 滴加石蕊溶液,溶液变红色 | ||
| C. | 加入蒸馏水,溶液颜色不变 | D. | 滴加酚酞溶液,溶液为无色 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com