
【题目】某化学兴趣小组的同学往氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.
(提出问题)氢氧化钠与盐酸是否发生了化学反应?
(查阅资料)酸与碱发生中和反应会放出热量.
(实验设计)甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告.
同学 | 实验操作 | 现象 | 结论 |
甲 |
| 溶液由红色变成 | 氢氧化钠与盐酸发生了化学反应,反应的化学方程式为 |
乙 |
| U型玻璃管中 边的红墨水液面下降(所加稀盐酸的体积忽略不计) | 氢氧化钠与盐酸发生了化学反应 |
丙 | 用 测定氢氧化钠溶液的pH,向其中滴加足量稀盐酸,再测定溶液的pH | 最后溶液的pH (填“≥7”、“≤7”、“不变” | 氢氧化钠与盐酸发生了化学反应 |
(评价反思)你认为实验设计方案不合理的同学是 ,理由是 .
(拓展延伸)另有一位同学向自己配制的氢氧化钠溶液中滴加酚酞试液时,溶液变红色,可是红色即可消失了,出现此意外情况的原因是 (填以下序号).
A.所用的酚酞试液是变质的
B.所用的氢氧化钠溶液浓度太小
C.氢氧化钠溶液吸收了空气中二氧化碳
【答案】[实验设计]甲:无色;HCl+NaOH=NaCl+H2O;乙:左;丙:pH试纸;≤7;[评价反思]乙;氢氧化钠固体溶于水也会放出热量;[拓展延伸]B.
【解析】
试题【实验设计】酚酞试液遇到碱溶液变红,遇到中性溶液或酸性溶液不变色,所以氢氧化钠中滴加盐酸使,当把氢氧化钠反应完了,溶液就会变为无色;反应物是氢氧化钠和盐酸,生成物是氯化钠和水,所以方程式是:HCl+NaOH=NaCl+H2O;
氢氧化钠固体溶于水会放出大量的热,氢氧化钠与盐酸反应也能放出热量,会导致瓶内温度升高,由于热胀冷缩,所以U型玻璃管中液面左侧下降右侧上升;
测定溶液的pH最简单的方法是使用pH试纸;中性溶液或酸性溶液都不能使酚酞试液变色所以最后所得溶液的pH值可能小于7,也可能等于7;
【评价反思】由于氢氧化钠固体溶于水会放出热量,到底热量是氢氧化钠与盐酸反应放出的,还是氢氧化钠固体溶于水放出的,无法判断,所以乙同学的实验现象不能说明氢氧化钠与盐酸发生了反应;
【拓展延伸】由于溶液变红色了,说明酚酞试液没有变质,故A错;氢氧化钠溶液吸收了空气中二氧化碳生成碳酸钠,也是显碱性,也能使酚酞试液变红,所以C答案错误;如果氢氧化钠溶液浓度太小会造成,开始滴加酚酞变红,红色即可消失.故选B.


科目:初中化学 来源: 题型:
【题目】为测定久置于空气中的氢氧化钠样品的变质程度,某化学活动小组称取该固体样品6.5g放入锥形瓶中,加水溶解,配成50g溶液,再向锥形瓶中滴加稀硫酸,反应过程中产生气体质量的部分实验数据和锥形瓶中溶液质量变化的图象如表所示:
加入稀硫酸的质量/g | 40 | 65 | 75 |
产生气体的质量/g | 1.1 | 2.2 | 2.2 |
(1)6.5g样品与稀硫酸完全反应产生气体的质量是________g。
(2)6.5g样品中碳酸钠的质量分数是________。(结果精确至0.1%)
(3)以上三次的实验数据中,只有一次加入的稀硫酸与锥形瓶中溶液的溶质恰好完全反应。
①如图图象中a的数值是________。
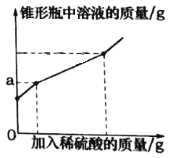
②求该实验中所用稀硫酸的溶质质量分数____。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以白云石(主要成分化学式为 MgCO3CaCO3)为原料制备氢氧化镁的工艺流程如下图(流程图方框中的文字均表示操作过程):
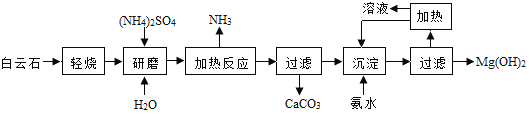
(1)白云石属于________物(选填“混合”“纯净”),白云石“轻烧”过程中只发生了碳酸镁的分解,写出碳酸镁分解反应的化学方程式________________。
(2)流程图中“加热反应”是指硫酸铵与氧化镁在加热条件下反应生成一种盐、氨气和水,其化学方程式为____________________; 流程图中“沉淀”过程是指氨水和硫酸镁发生复分解反应,其化学方程式为_________________; 硫酸铵中氮元素的化合价是_________价。
(3)该工艺中可以循环使用的物质是_______________、(NH4)2SO4 等.
(4)传统制备氢氧化镁的工艺是将白云石高温下分解为氧化镁和氧化钙后再提取,而本工艺流程采用轻烧白云石的方法,其优点是______________(填写一条,合理即可).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学反应的微观过程用图表示.则下列说法中,正确的是( )
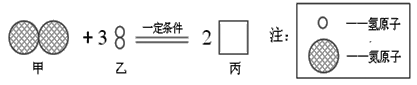
A. 该反应中分子和原子的种类都发生了改变
B. 物质丙的化学式为NH3
C. 甲、乙两物质参加反应的质量比为1:3
D. 图示反应属于分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习小组测定某工业废水中 H2SO4的含量。取 100g 废水于烧杯中,加入200gBaCl2 溶液,恰好完全反应,经过滤得到 253.4g 溶液(H2SO4 + BaCl2 = BaSO4 ↓+2HCl)(可溶性杂质不参加反应,过滤后滤液的损失忽略不计)
(1)充分反应后生成沉淀的质量为______g;
(2)该工业废水中硫酸的质量分数为____________?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)为了适应北方春季低温气候,在种植叶类蔬菜的时候适宜施加一种复合肥是___________(填化学式)氮肥有__________________,叶色浓绿,提高植物蛋白质含量的作用。
(2)牛奶可为人提供蛋白质,蛋白质是构成细胞的基本物质,是________________及修补受损组织的主要原料,通过食物获得的蛋白质和_____________(填化学式)等进入人体内都会先与水发生反应。
(3)若牛奶包装是一种塑料制品,它应该具有________性(填“热塑”或“热固”)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一瓶失去标签的溶液,知道只含有一种阳离子钾离子,为了弄清其到底含有几种溶质(都是初中常见的物质),四九芳华小组做了如下实验:(不考虑微溶和碳酸氢根)
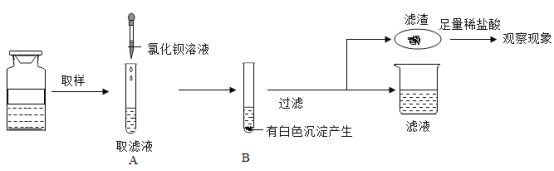
根据上述实验过程:小四同学根据滤渣处产生的_____________现象,从而确定了一定含有的两种溶质为___________,写出此过程反应的化学方程式:________。
还有那些溶质呢?小九同学继续探究如下图:
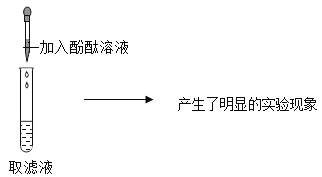
得出结论:该溶液一定含有氢氧化钾,请你对其结论进行评价_________;四九芳华小组经过讨论,觉得上述过程所加的试剂有一处不够明确和准确,从而对后续其他溶质的确定带来了影响,决定对一种试剂稍作调整,其他不变,调整为__________________,然后重新取滤液加入________,立即向所得溶液中加入__________,从而可推出瓶中溶液的溶质最多有__________种。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学实验小组对 “影响石灰石与盐酸反应速率的因素——盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与。
[进行实验]室温下,选用20mL不同溶质质量分数的盐酸(4%和6%)分别与1g颗粒状或块状的石灰石进行实验(固定夹持仪器略去)。
(1)石灰石与盐酸反应的化学方程式为___________________。
(2)按如图装置进行实验,在装药品前应检查该装置的气密性,具体的做法是____。
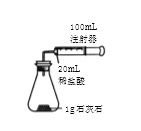
开始实验时,应将20mL稀盐酸_____________(填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中。
[处理数据](3)实验小组进行实验后,获得的相关实验数据如表所示:
实验 编号 | 盐酸的溶质质量分数 (均取20mL) | 石灰石固体形状 (均取1g) | 二氧化碳的体积/mL (均收集前30s的气体) |
a | 4% | 颗粒 | 64.0 |
b | 4% | 块状 | 40.4 |
c | 6% | 颗粒 | 98.2 |
d | 6% | 块状 | 65.3 |
①要比较不同溶质质量分数的盐酸对反应速率的影响,可选择的实验编号是_______(写一组),由此可得到的结论是_______________。
②从上述实验得出石灰石的颗粒大小对反应速率影响的结论是_____________。
(4)如表是实验时记录生成的二氧化碳气体的体积和对应的时间的一组实验数据(每间隔4s读数一次):
时间/s | 4 | 8 | 12 | 16 | 20 | 24 | 28 | 32 | 36 | 40 | |
气体体积/mL | 16.0 | 22.2 | 29.4 | 39.3 | 50.4 | 57.6 | 62.0 | 64.7 | 66.0 | 66.0 |
从上表数据可以分析得出,到20s后反应速率逐渐变____,其主要原因是___。
(5)你认为影响石灰石与盐酸反应速率的因素还有____,请设计实验方案验证你的猜想:____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硒元素在元素周期表的信息如图,下列说法正确的是
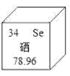
A. 硒原子核内有34个质子 B. 硒属于金属元素
C. 硒的相对原子质量是78.96 g D. 硒的中子数为34
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com