
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论及解释 |
| (1)取少量溶液A 于试管中,向其中滴加足量的稀盐酸; | 有气泡产生 | 猜想(1)不成立 |
| (2)另取少量溶液A于试管中,向其中滴加足量的氯化钙溶液; | 产生白色沉淀 | 反应的化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl |
| (3)将步骤(2)所得的混合液静置,向上层清液中滴加无色的酚酞溶液. | 溶液呈红色 | 猜想②成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
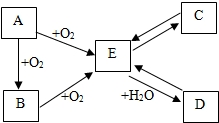 A、B、C、D、E是初中化学中常见的不同物质,其中A为黑色固体.其转化关系如图所示:
A、B、C、D、E是初中化学中常见的不同物质,其中A为黑色固体.其转化关系如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④①③② | C. | ③①④② | D. | ①②④③ |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 蛋白质 | B. | 油脂 | C. | 维生素 | D. | 无机盐 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
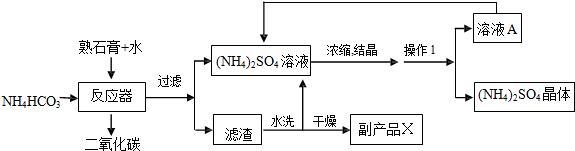
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
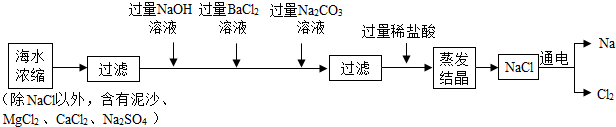
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com