解:【提出猜想】根据题意和资料:聚氯乙烯在空气中燃烧后产生的是无色混合气体,但猜想1中Cl
2是黄绿色的气体,故猜想I是错误的;
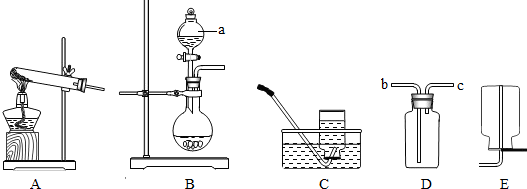
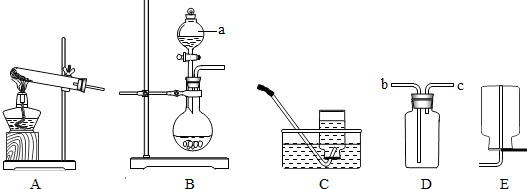
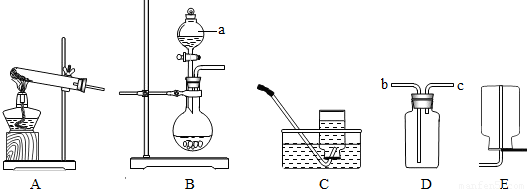
【实验探究】(1)①直接写出仪器的名称为:分液漏斗;
②根据题意可以知道所选择的装置既可以制取氧气同时也能制取二氧化碳气体,所以应该选择B装置,制取氧气应该选择双氧水来制取,故该反应的化学方程式为:2H
2O
2
2H
2O+O
2↑,该反应为分解反应;
③排空气法收集的到气体不是很纯但是比较干燥,而排水法收集的气体比较纯但是不干燥,故如果要得到较纯的气体应该选择排水法收集氧气,即C装置;
④氧气难溶于水,并且密度比水的小的多,所以如果用D装置来选择排水法收集时应该从c管进入集气瓶中;
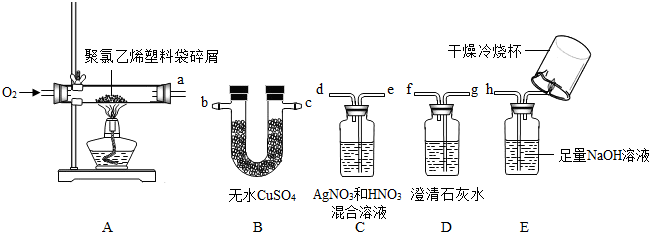
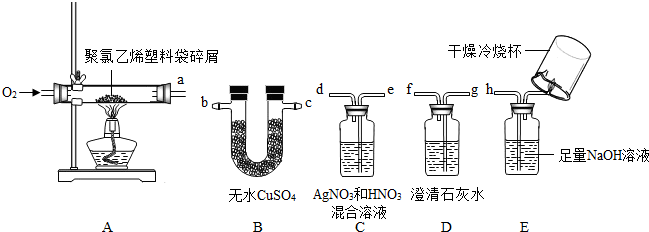
(2)①根据分析可以知道B装置是来验证水的存在的,而C装置可以来验证氯化氢的存在,D装置可以验证二氧化碳气体的存在,E装置可以检验一氧化碳的存在,故考虑到气体通过溶液会带出水蒸气,所以应该先检验水的存在,而氯化氢可以和氢氧化钙反应,所以应该先通C装置来验证并吸收氯化氢后在检验二氧化碳的存在,最后检验是不是含有一氧化碳,故该装置中导管的连接顺序为:bcedgfh(或cbedgfh);
②根据(2)中第①小题的解答可以知道装置B是验证并吸收水蒸气的,而C装置是验证氯化氢的气体,所以装置C中的现象为产生白色沉淀,装置D中发生的反应为:Ca(OH)
2+CO
2═CaCO
3↓+H
2O;
③我们知道E装置是来验证一氧化碳的存在的,如果存在一氧化碳,则燃烧会产生二氧化碳,故应该用澄清的石灰水来验证是否含有一氧化碳,从题中可以知道没有明显现象可以判断该混合气体中不含一氧化碳;;
实验结论:综合刚才的分析可以得出聚氯乙烯塑料燃烧产生了二氧化碳、水和氯化氢气体,即猜想2是正确的;
【实验反思】①有偿使用塑料袋可以提醒人们注意控制塑料袋的用量,同时可以减少白色污染,节约能源等;
②在连接装置时C和D不能调换,因为原混合气体中的HCl会与装置D中 Ca(OH)
2 反应,而无现象,装置C起不到验证HCl存在的作用了.
故答案为:【提出猜想】1; 根据题意和资料,聚氯乙烯在空气中燃烧后产生的是无色混合气体,但猜想1中Cl
2是黄绿色的气体,故猜想I是错误的;
【实验探究】(1)①分液漏斗
②B;2H
2O
2
2H
2O+O
2↑;分解;
③C;
④c;
(2)①bcedgfh(或cbedgfh);
②检验是否有水生成; 产生白色沉淀;Ca(OH)
2+CO
2═CaCO
3↓+H
2O
③澄清石灰水;一氧化碳或CO;
实验结论:2;
【实验反思】(1)减少白色污染或保护环境或节约能源;
(2)不能; 原混合气体中的HCl会与装置D中 Ca(OH)
2 反应,而无现象,装置C起不到验证HCl存在的作用了.
分析:【提出猜想】根据题给的信息聚氯乙烯的塑料制品燃烧时的现象可以完成该题的解答;
【实验探究】(1)①直接写出仪器的名称;
②根据题干信息及制取氧气和二氧化碳气体的反应原理来选合适的装置并写出化学方程式,判断出反应类型;
③根据排水法和排空气法收集气体的优缺点来解答该题;
④根据装置D的特点和氧气的性质来判断;
(2)①根据各装置的特点及作用,结合所作出的猜想来解答;
②根据装置中的物质来判断装置的作用、现象及发生的反应,并写出反应的化学方程式;
③根据装置的特点可以得出应该加入澄清石灰水来验证并判断是否有一氧化碳产生;
实验结论:通过综合刚才的实验来判断哪个猜想是正确的;
【实验反思】(1)从对环境的污染,节约能源等方面来解答;
(2)根据装置C和装置D中药品的作用来判断分析.
点评:在解此类题时,首先分析样品中各物质的性质,然后结合题中的现象进行分析,注意对新知识的应用要和题中的问题相结合,注意查阅资料部分,要仔细阅读,这往往是解这类题的提示.



 2H2O+O2↑,该反应为分解反应;
2H2O+O2↑,该反应为分解反应; 2H2O+O2↑;分解;
2H2O+O2↑;分解;