(2009?贵港)酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用.小强同学在做中和反应实验时,向盛有40g10%的氢氧化钠溶液的烧杯中逐滴加入稀盐酸,当恰好完全反应时,共滴加了36.5g稀盐酸.
(1)配置40g10%的氢氧化钠溶液需要水______mL.(ρ水=1.0g/mL)
(2)求:所加稀盐酸的溶质质量分数和反应后所得溶液中溶质的质量.(写出计算过程)
【答案】
分析:(1)由氢氧化钠溶液的质量和溶质质量分数可以计算出溶液中溶剂的质量.
(2)由氢氧化钠溶液的质量和溶质质量分数、稀盐酸的质量,根据化学方程式可以计算出稀盐酸的溶质质量分数和生成氯化钠的质量.
解答:解:(1)需要水的体积为
40g×(1-10%)÷1.0g/mL=36mL
(2)设稀盐酸中溶质的质量分数为x,反应生成的NaCl的质量为y
NaOH+HCl=NaCl+H
2O
40 36.5 58.5
40g×10% 36.5g×x y

=
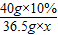
,x=10%
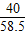
=
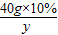
,y=5.85g
答:所加稀盐酸的溶质质量分数为10%;反应后所得溶液中溶质的质量为5.85g.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.

 =
=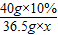 ,x=10%
,x=10%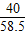 =
=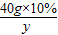 ,y=5.85g
,y=5.85g
