
(3分)为测定NaCl和Na2SO4固体混合物中NaCl的质量分数,化学小组同学进行如下实验活动: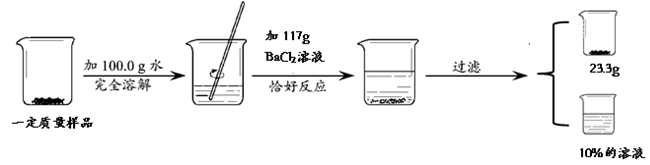
由此测得原固体混合物中NaCl的质量分数是多少?(已知:Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl)
设样品中氯化钠的质量为y,硫酸钠的质量为z,反应生成氯化钠的质量为x
Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl
142 233 117
z 23.3g x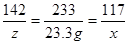
X=11.7g z=14.2g
10%=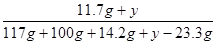 ×100% y=10.1g
×100% y=10.1g
NaCl%= ×100%=41.6%
×100%=41.6%
答:略
解析试题分析:由题意可知,生成的硫酸钡沉淀的质量为23.3g,反应的化学方程式为Na2SO4 + BaCl2 ===BaSO4↓ + 2NaCl,利用化学方程式即可求得生成氯化钠的质量和原有硫酸钠的质量;难点是原有氯化钠的质量设为y:已知所得氯化钠溶液质量分数为10%,利用质量守恒定律可得所得溶液的质量为 117g+100g+14.2g—23.3g,溶质为11.7g+y,列式解方程即可求得y;原固体混合物质量即可求得;原固体混合物中NaCl的质量分数即可求得.
考点:化学方程式的计算;溶质质量分数的计算


科目:初中化学 来源: 题型:单选题
在天平两边各放一只盛有等质量的相同溶质质量分数的稀硫酸的烧杯,把天平调至平衡,然后在左边烧杯中放入3.3克铝粉,为使天平平衡,向右边的烧杯中应加入镁粉的质量可能是( )
| A.6.6克 | B.3.3克 | C.3.2克 | D.2.4克 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(6分)
Na2CO3与盐酸反应分两步进行:
第一步反应为:Na2CO3+HCl===NaCl+NaHCO3;
第二步反应为:NaHCO3+HCl===NaCl+H2O+CO2↑
取Na2CO3溶液100g,逐滴加入稀盐酸直到过量。反应过程中产生的气体质量与加入
的盐酸质量的关系如图所示:
(1)反应中最多可以产生CO2___________g。
(2)求Na2CO3溶液中溶质质量分数(要求书写计算过程)。
(相对原子质量:C—12、Na—23、H—1、O—16)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(7分)某兴趣小组在实验室发现一瓶敞口久置的氢氧化钠和一瓶未标浓度的稀盐酸。为测定氢氧化钠的变质情况和稀盐酸的浓度,他们取9.3g变质的氢氧化钠样品于锥形瓶中,加人50g水,充分溶解,再向锥形瓶中滴加未知浓度的稀盐酸。实验测得加入稀盐酸的质量与锥形瓶中物质的质量关系如下图所示。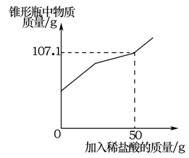
求:(1)9.3g样品中碳酸钠的质量。
(2)未知浓度的稀盐酸的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
⑴实验室需配制溶质质量分数为10%的氯化钡溶液100g,需称取氯化钡固体 克。
⑵称取氯化钠与碳酸钠的固体混和物22.3克放入烧杯中,加入氯化钡溶液到恰好完全反应(反应的化学方程式为BaCl2 + Na2CO3 = BaCO3↓ + 2NaCl),待反应完全后过滤,得白色沉淀19.7克和滤液200g。求:①固体混和物中所含碳酸钠的质量?
②滤液中所含溶质的质量分数?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(5分) 55.7 g碳酸钠溶液恰好与36.5 g某盐酸溶液完全反应,测得反应后溶液的质量为90 g,求:
(1)生成了多少克二氧化碳?
(2)反应后所得溶液的溶质质量分数是多少?
(3)所用稀盐酸中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(7分)经科学检测,蛋壳中含碳酸钙83—85%,蛋白质15—17%,并含有多种微量元素锌、铜、铁、硒等。小波同学为了亲自检测蛋壳中的某些成分以及含量,进行了实验探究。请回答相关问题:
(1)关于蛋壳的叙述中,你认为错误的一项是( )
| A.含钙、锌、铜、铁、硒等微量元素 |
| B.是由无机物和有机物等组成的混合物 |
| C.蛋壳焙干研粉,胃病患者服用,有止痛和治疗胃酸过多的效果 |
| D.可以加工成乳酸钙、葡萄糖酸钙等产品,变废为宝 |

查看答案和解析>>
科目:初中化学 来源: 题型:计算题
(3分)将Na2CO3和NaCl固体混合物32.9g放入烧杯中,此时总质量为202.9g,加入326.9g盐酸,恰好完全反应,待没有气泡逸出后再次称量,总质量为521.0g。计算所得溶液中溶质的质量分数(CO2的溶解忽略不计)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
重铬酸钾(K2Cr2O7Mr=294,铬元素为+6价,Mr表示相对分子质量)是一种重要的化工原料,在皮革工业、有机反应中都有广泛应用.但+6价格有很强的毒性易污染环境,使用后,须用绿矾,(FeSO4?7H2O,Mr=278)将其变成毒性+3价格才能做后续处理.反应原理是:6FeSO4?7H2O+K2Cr2O7+7H2SO4═3Fe2(SO4)3+Cr2(SO4)3+K2SO4+49H2O现有1.0吨重铬酸钾需要处理,计算需绿矾多少吨?(写出计算过程,结果精确到小数点后1位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com